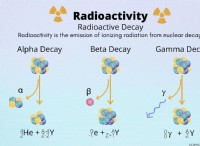
その理由は次のとおりです。
* 加水分解: 亜硫酸ナトリウムが水に溶解すると、加水分解を受け、ビゾルイオン(hso₃⁻)とナトリウムイオン(Na⁺)を形成します。亜硫酸水素イオンは、プロトン(H⁺)を水に寄付し、溶液を酸性にすることができます。
`` `
hso₃⁻ +h₂o
`` `
* 平衡: 平衡は右にあります。つまり、より多くのビスル酸イオンが陽子を寄付し、ヒドロニウムイオン(h₃o⁺)の濃度を増加させ、pHを下げます。
重要なメモ:
* 濃度: 亜硫酸ナトリウム溶液の正確なpHは、その濃度に依存します。より濃縮された溶液はより酸性になります。
* 温度: 温度もpHに影響します。 温度が高いほど、H₃O⁺の生産が促進され、溶液がより酸性になります。
他に質問がある場合はお知らせください!