主な違い – 有極性誘電体と無極性誘電体
誘電体は電気絶縁体です。それらは電気を伝導するための自由電子を持たないため、電気を伝導する材料ではありません。誘電体は、電場を加えることによって分極することができます。極性誘電体と非極性誘電体の 2 種類の誘電体があります。極性誘電体は、電気を伝導できない極性化合物です。非極性誘電体は、電気を伝導できない非極性化合物です。有極性誘電体と無極性誘電体の主な違いは、有極性誘電体は非対称の形状を持ち、無極性誘電体は対称的な形状を持つことです。
対象となる主な分野
1.極性誘電体とは
– 定義、極性、例
2.無極性誘電体とは
– 定義、極性、例
3.極性誘電体と非極性誘電体の違いは何ですか
– 主な相違点の比較
重要な用語:非対称、誘電体、絶縁体、無極性、極性、極性、対称

極性誘電体とは
極性誘電体は、電気を伝導できない極性化合物です。電気を伝導する自由電子がないため、電流は流れません。材料が極性誘電体である主な理由は、その形状です。これらの誘電体の形状は非対称です。
極性誘電体分子を考慮する場合、分子の極性は分子の形状または幾何学形状によって決まります。 2 つの異なる原子が互いに結合すると、極性共有化学結合が形成されます。元素が異なれば、電気陰性度の値も異なります。電気陰性度は、電子に対する親和性です。より高い電気陰性度を持つ原子は、結合電子をそれ自体に向かって引き付けます。次に、電気陰性度の低い原子は部分的に正に帯電し (電子不足により)、電気陰性度の高い原子は部分的に負に帯電します (電子密度が高いため)。これが共有結合の極性と呼ばれるものです。分子がいくつかの極性共有結合で構成されている場合、これらの結合の配置 (分子の形状) によって、極性分子であるかどうかが決まります。この分子が電気を伝導できない場合、それは極性誘電体です。
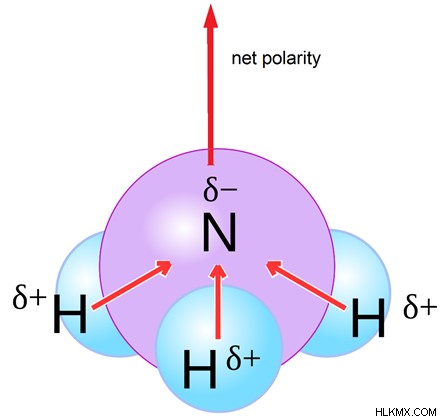
図 1:NH3 極性誘電体分子です
アンモニア分子は極性誘電体の良い例です。電気を通すことができる自由電子はありません。窒素原子は水素原子よりも電気陰性度が高く、3 つの N-H 結合の配置が三角錐であるため、極性分子です。
無極性誘電体とは
非極性誘電体は、電気を伝導できない非極性化合物です。電気を伝導する自由電子がないため、電流は流れません。材料が極性誘電体である主な理由は、その形状です。これらの誘電体の形状は対称です。
無極性の誘電体分子は、対称的な形状をしているため、無極性です。たとえば、CO2 は、2 つの C-O 結合を持つ線形分子です。 C-O結合は、炭素と酸素の電気陰性度の値の違いによる極性結合です。しかし、結合の配置は線形であるため、正味の極性はゼロです。したがって、それは非極性分子です。電気を通さない。したがって、それは非極性の誘電体分子です。
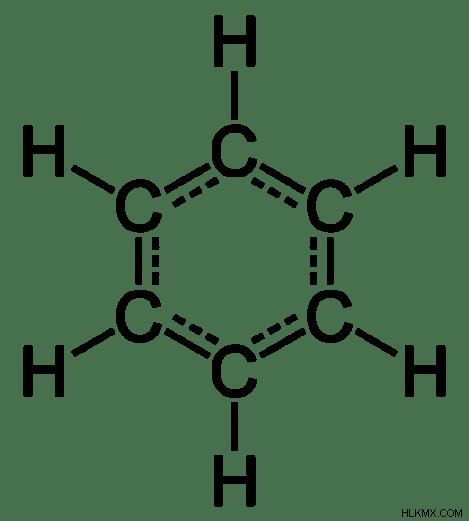
図 2:ベンゼンは非極性誘電体です
非極性誘電体化合物の例としては、メタン、ベンゼン、二酸化炭素、および電気を伝導できる自由電子を持たない他の多くの非極性化合物が含まれます。
極性誘電体と非極性誘電体の違い
定義
極性誘電体: 極性誘電体は、電気を伝導できない極性化合物です。
無極性誘電体: 非極性誘電体は、電気を伝導できない非極性化合物です。
形状
極性誘電体: 極性誘電体の形状は非対称です。
無極性誘電体: 無極性誘電体の形状は対称です。
極性
極性誘電体: 極性誘電体は極性です。
無極性誘電体: 無極性誘電体は無極性です。
例
極性誘電体: アンモニアと HCl は極性誘電体の良い例です。
無極性誘電体: ベンゼン、メタン、二酸化炭素は無極性誘電体の良い例です。
結論
誘電体は、電気を通すことができない化合物です。これらの誘電体は、分子の極性に応じて、極性誘電体または非極性誘電体として見られます。極性誘電体と非極性誘電体の主な違いは、極性誘電体は非対称の形状を持ち、非極性誘電体は対称形状を持つことです。