* フッ素(F): 3つの中で最小の原子半径。
* 酸素(O): フッ素よりも大きいが、塩素よりも小さい。
* 塩素(cl): 3つの最大の原子半径。
なぜこれが?
* 定期的な傾向: 一般に、原子半径は、周期表のグループ(列)を下ると増加し、左から右に期間(行)を移動すると減少します。
* 電気陰性度: フッ素は最も電気陰性の要素であり、それが電子を強く引き付けることを意味します。この強い引っ張りにより、電子クラウドがよりコンパクトになり、原子半径が小さくなります。
* シールド: グループを下に移動すると、電子シェルの数が増加し、核と最も外側の電子の間をより多くのシールドを作成します。これにより、有効な核電荷が減少し、原子半径が拡大します。
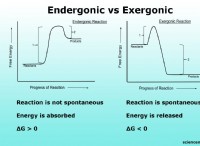
要約:
フッ素の小さな原子半径は、その電気陰性度と2つの電子シェルしかないという事実によるものです。酸素は、電気陰性度がわずかに低く、電子シェルが追加されているため、半径が大きくなります。塩素はさらに多くの電子殻を備えており、より多くのシールドを提供し、有効な核電荷を減らすため、最大の半径を持っています。