* 自発反応: これらの反応は、継続的な外部エネルギー入力を必要とせずに、それ自体で起こります。彼らはより低いエネルギー状態に向かって進む傾向があります。
* 吸熱反応: これらの反応は、周囲から熱を吸収します。 これは、彼らが発生するためにエネルギーの入力を必要とすることを意味します。
吸熱反応が自発的ではない理由:
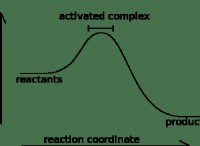
* 熱力学: 反応の自発性は、Gibbs Free Energy(ΔG)と呼ばれる概念によって支配されています。 反応が自発的であるためには、ΔGは陰性でなければなりません。
* Δg方程式: Δg=Δh -tδs
*ΔHはエンタルピー変化(熱吸収または放出)です
* tはケルビンの温度です
*ΔSはエントロピーの変化(障害の変化)です
* 吸熱反応とΔg: 吸熱反応は正のΔH(熱を吸収する)を持っているため、ΔG値はエントロピーの変化(ΔS)が十分に大きく、温度が正のΔHを克服するのに十分高い場合にのみ負になります。
吸熱反応の例:
* 溶融氷: 水分子を固体状態に保持する結合を壊すために熱が必要です。
* 光合成: 植物は日光を吸収して、二酸化炭素と水をグルコースと酸素に変換します。
重要な注意: 吸熱反応は一般に標準条件下では自発的ではありませんが、十分なエネルギーの入力で発生するようにすることができます。 このエネルギーは次のように提供できます。
* 熱: 温度を上げると、エネルギー障壁を克服するために必要な活性化エネルギーを提供できます。
* 他の形態のエネルギー: 光、電気、または機械的エネルギーも吸熱反応を促進する可能性があります。