基本を理解する
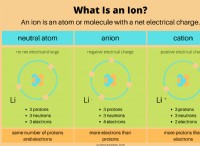
* 酸: 酸は水素イオン(H+)を溶液に放出します。 7未満のpHがあります。
* ベース: 塩基は、溶液から水素イオン(H+)を受け入れるか、水酸化物イオン(OH-)を溶液に放出します。彼らは7を超えるpHを持っています。
* ニュートラル: ニュートラル溶液のpHは7です。これは、H+イオンの濃度がオハイオンの濃度に等しいことを意味します。
中和反応
酸にベースを追加すると、次の反応が発生します。
酸 +ベース→塩 +水
* 酸からの水素イオン(H+)は、塩基から水を形成する水酸化物イオン(OH-)と反応します(H2O)。。 これにより、溶液からH+およびOh-イオンが除去されます。
* 酸と塩基からの残りのイオンが組み合わされて塩を形成します。
例:
* 塩酸(HCl)は酸です。
* 水酸化ナトリウム(NAOH)は塩基です。
反応は次のようになります:
hcl(酸) + naOH(ベース)→NaCl(塩) + H2O(水)
なぜ中和が起こるのか
* H+およびOHイオンを除去することにより、溶液は酸性度が低く、塩基性が低くなります。
* H+イオンの濃度が減少すると、溶液のpHが増加し、7に近づきます。
* pHが7に達すると、溶液はニュートラルになります。
重要な注意: 中和を達成するために必要な酸とベースの量は、その濃度に依存します。 存在するすべての酸と完全に反応するのに十分なベースを追加する必要があります。