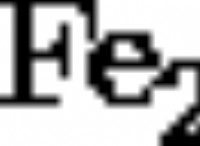その理由は次のとおりです。
* 水は極性分子です: 水中の酸素原子は、その電気陰性度が高いため、わずかに負電荷(Δ-)を持ちますが、水素原子はわずかに正電荷(Δ+)を持っています。
* 反対の魅力: 水分子の負に帯電した酸素端は、正に帯電したナトリウムイオン(Na+)に引き付けられます。この相互作用は、イオン双極子相互作用と呼ばれます 。
* 塩化ナトリウム溶解: この魅力は、NaCl結晶にナトリウムと塩化物イオンを一緒に保持している強力なイオン結合を克服し、塩を溶かします。
同じ原理は、塩化物イオン(CL-)に適用されます。これは、水分子の積極的に帯電した水素端に引き付けられます。