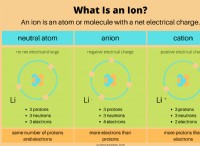
1。電子の伝達:
* 金属 を失う傾向があります 電子、積極的に帯電したカチオン 。
* 非金属 ゲイン 電子、マイナス帯電アニオン 。
2。イオンの形成:
*金属による電子の損失は、正に帯電したイオン(陽イオン)を作成します。
*非金属による電子の獲得は、負に帯電したイオン(アニオン)を作成します。
3。静電引力:
*反対に帯電したイオンは、静電力のために互いに引き付けます 。この強い魅力は、イオン結合を形成します 。
4。中性化合物の形成:
*陽イオンとアニオンの電荷のバランスが取れているため、中性化合物 。
例:ナトリウム(Na)および塩素(Cl)
* ナトリウム(Na) 、金属、1つの電子を失い、ナトリウム陽イオン(Na+) 。
* 塩素(cl) 、非金属は、1つの電子を獲得して塩化物アニオンになります(cl-) 。
*正に帯電したナトリウム陽イオンと負に帯電した塩化物アニオンは互いに引き付けられ、イオン結合を形成します 。
*これにより、塩化ナトリウム(NaCl)が形成されます。 、テーブルソルトとも呼ばれます。
キーポイント:
*イオン結合は、反対に帯電したイオン間の強い結合です。
*イオン化合物は通常、室温で固体であり、融点と沸点が高い。
*イオン化合物は通常、水に溶けます。
*水に溶けたり溶けたりすると、電気の良好な導体です。
イオン化合物の他の例:
*塩化カリウム(KCL)
*酸化マグネシウム(MGO)
*炭酸カルシウム(CACO3)
*酸化アルミニウム(AL2O3)
金属と非金属も共有結合を形成できることを忘れないでください 彼らが電子を共有する場所。ただし、これは2つの非金属間でより一般的です。