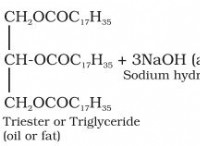その理由は次のとおりです。
* 極性: 水分子の形状は、水素側にわずかに正電荷で、酸素側にわずかに負の電荷を伴う曲がっています。この不均一な電荷分布は、極性分子になります。
* アトラクション: この極性により、水分子は他の極性分子と水素結合を形成できます。これらの結合は、他の物質を一緒に保持している債券を破壊するのに十分な強さであり、それらを溶解させます。
* "like like dislols like": 極性のため、水は糖、塩、アルコールなどの他の極性分子に適した溶媒です。脂肪や油などの非極性分子を溶解するのに効果が低いです。
本質的に、他の極性分子と水素結合を形成する水の能力は、その溶媒特性の鍵です。