その理由は次のとおりです。
* pHスケール: pHスケールは、溶液の酸性度またはアルカリ度を測定します。 0から14の範囲で、
* 0-6酸性である
* 7中立
* 8-14アルカリ性(または塩基性)
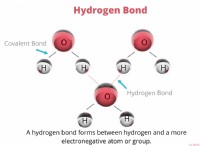
* 水素イオン: 酸性度は、溶液中の水素イオン(H+)の濃度によって決定されます。 H+イオンが多いほど、溶液が酸性になります。
* 水の平衡: 純水には、非常に少量のH+イオンと等量の水酸化物イオン(OH-)が含まれています。 これらのイオンは、水分子がH+とOH-に分割される水分子の自動イオン化プロセスを通じて形成されます。この平衡は、中性pHをもたらします。
何が水を酸性にしますか?
H+イオンを放出する物質がそれに加えられると、水は酸性になる可能性があります。 例えば:
* 酸: 塩酸(HCl)のような酸は、H+イオンを溶液に容易に供給し、酸性を作ります。
* 二酸化炭素: 二酸化炭素が水に溶解すると、炭酸(H2CO3)を形成し、H+イオンを放出してpHを下げます。これが雨水がわずかに酸性になる方法です。
したがって、純粋な水は中性ですが、H+イオンを放出する他の物質が存在する場合、酸性になる可能性があります。