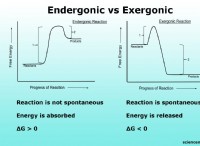
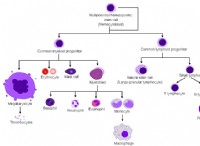
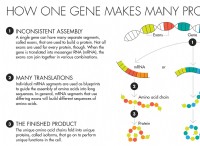
これが故障です:
* 共有結合: 2つの原子間で電子の共有によって形成される化学結合。
* 極性共有結合: 電子が不均等に共有される共有結合により、一方の原子に部分的な正電荷と他の原子に部分的な負電荷が得られます。
* 電気陰性度: 原子が化学結合で自分自身に向かって電子を引き付ける能力。
極性結合結合を伴う分子の例:
* 水(h₂o): 酸素は水素よりも電気陰性であるため、電子は酸素原子の近くでより多くの時間を費やし、部分的な負電荷と水素原子が部分的な正電荷を与えます。
* 塩化水素(HCl): 塩素は水素よりも電気陰性であり、極性の共有結合をもたらします。
* アンモニア(nh₃): 窒素は水素よりも電気陰性であり、極性共有結合を引き起こします。
極性結合結合を伴う分子の重要な特性:
* 不均一な電子分布: 電子は原子間で等しく共有されません。
* 部分料金: 原子は、不均一な電子共有のために部分的な正または負の電荷を発症します。
* 双極子モーメント: 分子には正味の双極子モーメントがあります。つまり、正の終わりと負の端があります。
* 溶解度: 極性分子は、多くの場合、極性溶媒(水など)に溶けます。
注: 極性結合結合を持つすべての分子が極性であるわけではありません。たとえば、二酸化炭素(CO₂)には2つの極性共有結合がありますが、分子は線形で対称的であるため、極性がキャンセルされ、非極性分子になります。