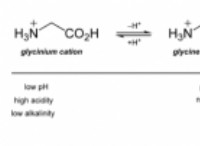
分子化合物は、非金属原子間の電子の共有によって形成され、共有結合をもたらします。ここにいくつかの重要な特性があります:
1。結合:
* 共有結合: 原子は電子を共有して、安定した電子構成を実現します。
* 極性共有結合: 電子は不均等に共有され、分子内で部分的な正電荷と負の電荷が生じます。
* 非極性共有結合: 電子は原子間で等しく共有されます。
2。物理的特性:
* 融点と沸点の低い: より弱い分子間力(ファンデルワールス力や水素結合など)は分子を一緒に保持し、イオン化合物と比較して融点と沸点が低下します。
* 一般に、室温でのガスまたは液体: 多くの分子化合物は、分子間力が比較的弱いため、室温のガスまたは液体として存在します。
* 可変硬度: 分子構造と分子間力に応じて、柔らかく、脆く、または柔軟になる可能性があります。
* 熱と電気の導電率が低い: 自由移動した荷電粒子がないため、熱や電気をうまく伝達しないでください。
* しばしば非極性溶媒に溶けます: 同様の分子間力により、油や脂肪などの非極性溶媒に溶解する傾向があります。
3。化学的特性:
* 電子を共有することによる形式: 原子は電子を共有して、安定したオクテットを実現します。
* 比較的低い反応性: 一般に、結合はより安定しているため、イオン化合物よりも反応性が低くなります。
* 燃焼: 多くの分子化合物は可燃性であり、燃焼反応を起こす可能性があります。
4。例:
*水(h₂o)
*二酸化炭素(co₂)
*シュガー(c₁₂h₂₂o₁₁)
*メタン(ch₄)
*エタノール(c₂h₅oh)
イオン化合物との重要な違い:
*イオン化合物は、金属と非金属間の電子の伝達によって形成されます。
*イオン化合物は、強い静電力により、はるかに高い融点と沸点を持っています。
*イオン化合物は通常、室温で固体です。
*イオン化合物は、水に溶解すると、熱と電気の良好な導体です。
要約: 分子化合物は、電子の共有によって形成され、融点と沸点が比較的低く、室温でのガスまたは液体であることが多く、一般にイオン化合物よりも反応性が低くなります。