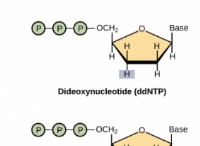
その理由は次のとおりです。
* 極性: カルボニル基とヒドロキシル基の両方の酸素原子は、炭素および水素原子よりも電気陰性です。これは、酸素原子が自分に向かって電子密度を引き出すことを意味し、酸素に部分的な負電荷(Δ-)を作成し、炭素と水素に部分的な正電荷(Δ+)を作成します。
* 水素イオン寄付: ヒドロキシル基の部分的に陽性の水素は比較的簡単に除去されます。結果として生じる負に帯電したカルボキシレートイオン(COO-)は共鳴によって安定化されます。この水素イオン(H+)は、酸を定義するものです。
要約:
*カルボキシル基の極性は、容易に利用可能な水素イオンを作成します。
*結果として得られるカルボキシレートイオンの安定性により、水素イオンの除去が良好になります。
したがって、カルボキシル基は陽子(H+)をベースに寄付し、酸として作用することができます。