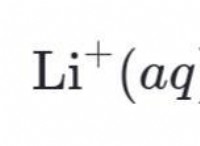多くのイオン性化合物は水に溶けますが、それらすべてに当てはまりません。その理由は次のとおりです。
* 溶解度は、力の相互作用に基づいています: 溶解度は、互いにイオン化合物のイオンの魅力(格子エネルギー)と水分子へのイオンの誘引(水和エネルギー)とのバランスに依存します。
* 溶解度に影響する要因:
* 電荷密度: 高度に帯電したイオン(mg²⁺、al³⁺など)は、互いにより強い魅力を持ち、バラバラになるためにより多くのエネルギーを必要とし、それらをより少なくします。
* イオンのサイズ: より小さなイオンは、電荷密度が高いため、より溶けやすい傾向があります。
* 極性: 水は極性溶媒です。つまり、正と負の端があります。これにより、イオンと相互作用して引き離すことができます。非極性化合物は、水に溶解しません。
* 一般的な溶解度ルール: イオン化合物の溶解度のための一般的な経験則がいくつかありますが、それらは絶対的ではありません。たとえば、ほとんどのグループ1とアンモニウム塩は可溶性ですが、例外があります。
不溶性イオン化合物の例:
* 塩化銀(AGCL): イオン化合物であるにもかかわらず、それは水に非常に不溶です。
* 炭酸カルシウム(Caco₃): これは石灰岩の主要な成分であり、実際には水に不溶です。
* 硫酸バリウム(BASO₄): 医療イメージングで使用されているため、ほぼ完全に不溶です。
要約: ほとんどすべてのイオン化合物が水に溶けやすいと言うのは間違っています。 溶解度は、いくつかの要因の影響を受ける複雑な現象であり、多くのイオン化合物は実際には不溶性です。