酸塩基滴定対酸化還元滴定:重要な違い
酸塩基の滴定と酸化還元滴定の両方は、未知の溶液の濃度を決定するために使用される分析手法ですが、基礎となる原則と用途が大きく異なります。
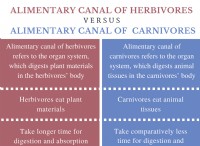
酸ベース滴定:
* 原則: 酸と塩基の間の中和反応に基づいています。
* 反応: 酸からのH+イオンは、塩基からのOh-イオンと反応し、水(H2O)を形成します。
* インジケーター: 滴定のエンドポイントを視覚的に通知するために使用され、通常、ニュートラルなpHで色を変えます。
* 例: 水酸化ナトリウムの標準化された溶液を使用して、酢溶液(酢酸)の濃度を決定します。
酸化還元滴定:
* 原則: 2つの反応物間の電子の伝達に基づいています。
* 反応: 1つの反応物は酸化され(電子が失われます)、もう1つは還元されます(電子を獲得します)。
* インジケーター: 溶液の酸化還元電位に基づいて色を変える、自己指標(反応物の変化する色)または酸化還元指標になることがあります。
* 例: 過マンガン酸カリウムの標準化された溶液を使用した鉄(II)溶液の濃度の決定。
重要な違い:
|機能|酸塩基滴定|酸化還元滴定|
| -------------------- | -------------------------- | ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
| 原則 |中和|電子移動|
| 反応型 |酸塩基|酸化還元|
| インジケータ | pH感受性|酸化還元電位に敏感|
| 一般的な例 |酸濃度、塩基濃度|酸化剤または還元剤の濃度|
| アプリケーション |食品化学、環境分析|冶金、水質分析|
要約:
酸塩基の滴定は、酸と塩基の濃度を決定するために、H+およびOHイオンの反応に依存しています。酸化還元滴定は、電子移動反応に焦点を当てており、酸化剤と還元剤の分析に役立ちます。 それらは、分析化学においてさまざまな目的を果たす明確な手法です。