その理由は次のとおりです。
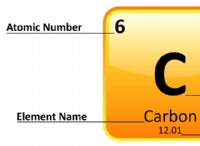
* 化学式: あなたが説明している反応は、アルミニウムの燃焼です。
4 al + 3o₂→2al₂o₃
* 化学量論: この方程式は、反応物と生成物の比率を示しています。 反応する4モルのアルミニウム(AL)ごとに、2モルの酸化アルミニウム(Al₂O₃)を生成するには3モルの酸素(O₂)が必要です。
* 情報の不足: アルミニウムの質量(1020g)を与えましたが、酸素の質量を提供していません。形成される酸化アルミニウムの量を計算するには、酸素の量が必要です。
この問題を解決する方法:
1。アルミニウムのモルを見つけます:
- アルミニウムの質量をモル質量(26.98 g/mol)で除算します。
2。必要な酸素のモルを決定する:
- バランスの取れた方程式(4 al:3o₂)のモル比を使用します。
3。生成された酸化アルミニウムのモルを計算します:
- バランスの取れた方程式(4 al:2al₂o₃)のモル比を使用します。
4。酸化アルミニウムのモルをグラムに変換:
- 酸化アルミニウムのモルにモル質量(101.96 g/mol)を掛けます。
例:
1020 gのアルミニウムと反応する500 gの酸素があったとしましょう。 これがあなたがそれを解決する方法です:
1。アルミニウムのモル: 1020 g al / 26.98 g / mol =37.80 mol al
2。酸素のモル: 500 go₂ / 32.00 g / mol =15.63 molo₂
3。制限反応物: アルミニウムは、モル比(37.80 mol Al / 4 <15.63 molo₂ / 3)に基づいて必要以上のものがあるため、制限反応物です。
4。酸化アルミニウムのモル: 37.80 mol al *(2 molal₂o₃ / 4 mol al)=18.90 molal₂o₃
5。酸化アルミニウムのグラム: 18.90 molal₂o₃ * 101.96 g/mol = 1931.2 gal₂o₃
化学反応を含む計算を求めるときは、常にすべての反応物の質量を提供することを忘れないでください。