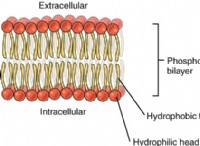
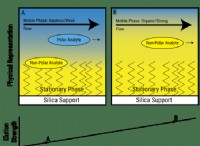
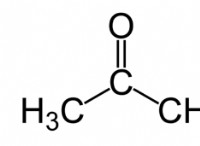
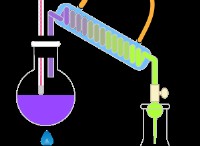
1S²2S²2P⁶3S²3P⁶4S²3D⁸
説明:
* 1S²: 最初のエネルギーレベル(n =1)には、最大2つの電子を保持できる1つのサブレベルがあります。
* 2S²2P⁶: 2番目のエネルギーレベル(n =2)には2つのサブレベル(sとp)があります。 Sサブレベルは2つの電子を保持し、Pサブレベルは6を保持します。
* 3S²3p⁶: 3番目のエネルギーレベル(n =3)には、SおよびPサブレベルもあり、それぞれが最大容量で満たされています。
* 4S²3D⁸: これは少し注意が必要です! 4Sサブレベルは、一般的にエネルギーが低いため、3Dサブレベルの前に埋められます。ただし、ニッケルのような遷移金属の場合、3Dサブレベルは部分的にしか満たされていません(8電子で)。
単純化された表記:
この配置をより簡潔な方法で表現することもできます。
* [ar]4s²3d⁸
この表記法は、以前のノーバーガス(Argon- [AR])を速記として使用して、充填された内側のシェルを表します。
重要な注意: ニッケルの実際の電子構成はより複雑であり、HundのルールとAufbauの原則が含まれます。この単純化されたバージョンは、軌道内に電子がどのように分布するかについての一般的な理解を提供します。