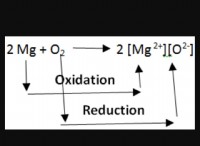
水に溶解する結晶(可溶性):
* 塩: 一般的なテーブル塩(NaCl)、エプソム塩(MGSO₄)、塩化カリウム(KCL)、その他多く。
* 砂糖: スクロース(テーブルシュガー)、フルクトース、グルコース。
* いくつかの酸: クエン酸、酢酸(酢で見つかった)、塩酸。
* いくつかのベース: 水酸化ナトリウム(LYE)、水酸化カリウム。
* 多くのイオン化合物: これらは、反対に帯電したイオンの魅力によって形成される化合物です。水分子はイオンを囲み、引き離すことができるため、水に溶けやすい傾向があります。
水に溶けない結晶(不溶性):
* ほとんどの金属: 金、銀、鉄、銅など
* 多くの鉱物: クォーツ、ダイヤモンド、サファイア、ルビーなど。
* ほとんどの有機化合物: プラスチック、ゴム、木。
溶解度に影響する要因:
* 温度: 一般に、溶解度は温度とともに増加します。
* 圧力: 液体に溶解したガスの場合、溶解度は圧力とともに増加します。
* 極性: 水は極性溶媒です。つまり、非極性分子(オイルなど)よりも極性分子(砂糖など)が溶解します。
重要なメモ:
* 溶解は化学プロセスです: 結晶が水に溶けると、成分イオンまたは分子に分解されます。
* 溶解度はスペクトルです: いくつかの結晶は非常に溶けやすいですが、他の結晶はわずかに溶けやすいです。
* 「不溶性」という意味ではありません: おそらく不溶性の結晶でさえ、溶解する少数の量があるかもしれません。
さらに質問があるか、具体的な例が必要な場合はお知らせください!