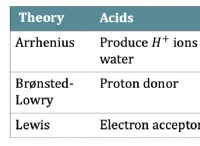
1。酸化と還元を特定します
* 酸化: 電子の損失(酸化数の増加)
* 削減: 電子のゲイン(酸化数の減少)
反応で:
Fe(s) + 2HCl(aq)→fecl₂(aq) +h₂(g)
* 鉄(fe) 0(元素形式)の酸化状態からfecl₂の+2に移動します。これは酸化です。
* 水素(H) HClの+1の酸化状態からH₂で0になります。これは削減です。
2。酸化の半分反応を書きます
酸化半反応は、酸化されている種に焦点を当てています。
fe(s)→fe²⁺(aq) +2e⁻
説明:
* fe(s): これは、元素の形で始まる固体鉄です。
* fe²⁺(aq): これは、現在溶液中の鉄イオンであり、+2電荷です。
* 2e⁻: これは、酸化プロセス中に鉄原子によって失われた2つの電子を表します。
重要な注意: HClの水素イオン(H⁺)も全体的な反応に関与しています。ただし、それらは酸化半反応ではなく、還元半反応の一部です。