基本を理解する
* 削減の可能性: 種の還元電位(E°)は、電子を獲得して減らす傾向を測定します。より正のE°は、減少する傾向が大きいことを示します。
* 酸化: 削減の反対。 酸化では、種は電子を失います。
酸化の半分反応を書き込む手順
1。酸化されている種を識別します: 全体的な反応で電子を失う種を探しています。
2。チャートでの半分反応の削減を見つけます: 種と、それに対応する還元の半分反応を還元潜在チャートで見つけます。
3。反応を逆転させます: 酸化を表すには、半分反応の減少を逆転させる必要があります。これは、反応物と製品をひっくり返すことを意味します。
4。 e°値の符号を変更します: 反応を逆転させると、還元電位の兆候も変わります。
5。電荷と質量のバランス: 原子と電荷の数が方程式の両側でバランスが取れていることを確認してください。
例:
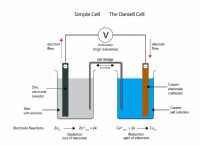
亜鉛金属と銅(II)イオンとの反応のための酸化半反応を書きたいとしましょう。
全体的な反応: Zn(s) +cu²⁺(aq)→zn²⁺(aq) + cu(s)
手順:
1。酸化されている種を識別します: 亜鉛(Zn)は、電子を失うため酸化されています。
2。その削減半反応を見つけます: チャート上のZn²⁺(aq)の半分反応の減少を探してください:Zn²⁺(aq) +2e⁻→zn(s)e°=-0.76 v
3。反応を逆転させます: Zn(s)→Zn²⁺(aq) +2e⁻
4。 e°:の符号を変更します E°=+0.76 v
5。バランス(すでにバランスが取れている)
結果として生じる酸化半反応:
Zn(s)→Zn²⁺(aq) +2e⁻e°=+0.76 v
キーポイント: 酸化半反応は、減少半反応の逆であり、そのポテンシャルは減少の可能性の陰性です。