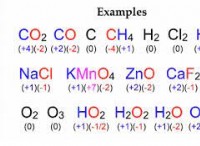
1。基本を理解する:
* 酸化番号: すべての結合が100%イオンである場合、原子が持つ仮想電荷を表します。
* 遷移金属: 複数の酸化状態を持つことで知られている周期表のDブロックの要素。
2。ルールとガイドライン:
* ルール1:元素形式の要素の酸化数は0です。 (例えば、Fe、Cu、Au)
* 規則2:中性化合物の酸化数の合計は0です。
* 規則3:ポリ原子イオンの酸化数の合計は、イオンの電荷に等しくなります。
* 規則4:グループ1要素(アルカリ金属)には常に+1の酸化数があります。
* 規則5:グループ2要素(アルカリの土の金属)には常に+2の酸化数があります。
* 規則6:酸素の酸化数は通常-2です(過酸化物を除く、-1)。。
* 規則7:水素の酸化数は+1です(金属水素化物を除く-1)。。
* 規則8:ハロゲン(f、cl、br、i)は通常、-1の酸化数があります。
3。 酸化数の決定:
1。化合物またはイオンの遷移金属を識別します。
2。上記のルールを使用して他の要素に酸化番号を割り当てます。
3。酸化数の合計を表す方程式を設定します。
*中性化合物の場合、合計は0に等しくなります。
*多原子イオンの場合、合計はイオンの電荷に等しくなります。
4。遷移金属の酸化数の方程式を解きます。
例:
* fecl3:
*塩素(Cl)の酸化数は-1です。
* 3 Cl Atoms =3 x(-1)=-3
*したがって、Feは電荷のバランスをとるために+3の酸化数を持っている必要があります。
* mno4-(パーマンガン酸イオン):
*酸素(O)の酸化数は-2です。
* 4 o原子=4 x(-2)=-8
*イオンの全体的な電荷は-1です。
* Mn +(-8)=-1
*したがって、Mnの酸化数は+7です。
ヒント:
*ローマ数字を使用して、化合物名の遷移金属の酸化状態を示します(例えば、塩化鉄、銅(II)硫酸塩)。
*プロセスに慣れるために、多くの例で練習します。
注: 遷移金属の酸化数は、その一部である化合物またはイオンによって異なります。 一般的なルールにはいくつかの例外もあります。