ネルンストの式とは?
ネルンストの式は、既知の温度、圧力、および濃度での電気化学セル電位を計算します。この式は、非標準条件でのセルの還元電位を標準条件 (298K、1 atm、および 1 M 濃度) の還元電位に関連付けます。
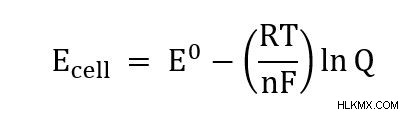
- Eセル =細胞の可能性
- E =標準条件下での細胞の可能性
- R =普遍気体定数 (8.314 J/(mol*K))
- T =温度
- n =反応で移動した電子の数
- F =ファラデー定数 (96485 C/mol)
- Q =反応指数
Q は、必ずしも平衡ではないことを除いて、平衡定数 (K) と同じです。非標準セル電位を見つけようとしているので、Q を使用することは理にかなっています。
この方程式を使用して、さまざまな電気化学セルの半電池反応またはセル電位を求めることができます。
式は、RT/nF という項が定数に簡略化された他のいくつかの形式で書かれているのも見られます。たとえば、式を pH 式に近づけるために、自然対数を対数に変更できます。
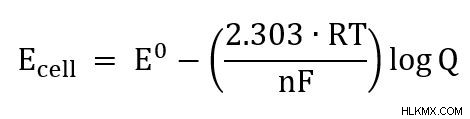
25C のセルの場合、式は次のように簡略化できます
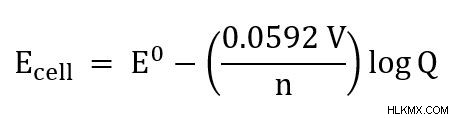
ネルンストの式は、反応物の濃度の増加に対する細胞電位の増加を決定するのにも役立ちます。 Qが1の場合、セル電位は標準セル電位と同じになります。 Q の他の値は、セル電位が標準とは異なる原因となります。 1 を超える Q 値は、細胞電位が標準よりも低くなることを意味します。 1 未満の Q 値は、標準よりも高いことを意味します。
細胞電位がよりプラスになると、反応が起こりやすくなります。
ネルンスト方程式の導出
ネルンストの方程式は、ギブスの自由エネルギーから導き出されます。
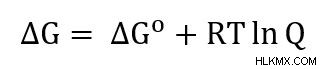
この方程式は、ΔG =-nFE と ΔG =-nFE の定義を使用して書き直すことができます。
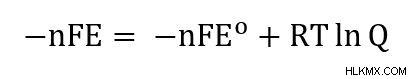
簡単にするために、各辺を -nF で割ると、一般的に書かれているネルンスト方程式に到達します。
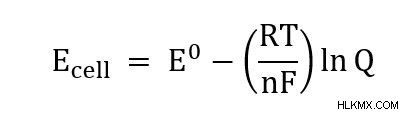
方程式を使った問題例
問題 :鉛 (Pb) と銀 (Ag) を 25 ℃ で使用する電気化学セルがあります。セルの反応を以下に示します。
Pb(s) + 2 Ag (aq) –> Pb(aq) + 2Ag(s)
[Ag+] =0.75 M および [Pb2+] =0.1 M の場合のセル電位を計算します。標準セル電位は 0.93 V です。
有効なソリューション:
最初に、発生している反応を書き出し、標準セルの電位 (E) がまだ与えられていない場合はそれを見つけます。この場合、反応と細胞電位は問題で与えられます。標準セルの電位を見つける方法については、電気化学セルのチュートリアルを参照してください。
次に、与えられた値または既知の値をネルンストの式に代入し始めます。この問題では、n、Q、および E を差し込むことができます。ガス定数 (R) とファラデー定数 (F) は、0.0592 V の値に簡略化された定数です。この簡略化は、25C で作業しているため可能です。
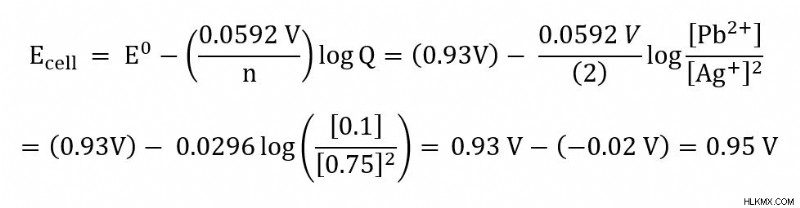
Q の場合、反応の固体成分は値に含まれないことに注意してください。したがって、この例では、Pb(s) と Ag(s) は含まれていません。 n 値は、反応で 2 モルの電子が移動することから得られます。
問題が発生したときは単位をチェックして、最終的に正しい単位になっていることを確認してください。特に、25 ℃ での作業に簡略化された係数を使用できない場合はそうです。
ネルンストの式の限界
ネルンストの式の限界が現れることはめったにありませんが、この式にはいくつかの仮定があります。以下は、ネルンストの式が不正確になるいくつかの状況です。
- 濃度が非常に高い場合、ネルンストの式は不正確になります。反応物または生成物の濃度が非常に高くなると、電位を決定するために実験が使用されます。
- 非常に希薄な溶液では、予測される可能性が無限大に達する可能性がありますが、これは現実的ではなく、無視する必要があります。
- セルに電流が流れている場合、この式は使用できません。電流は、イオンの活性 (有効濃度) を変化させます。この影響により、方程式が不正確になります。
豆知識:
- ドイツの化学者であるヴァルター・ヘルマン・ネルンスト (1864-1941) が方程式を開発しました。
- ネルンストは、熱化学に関する業績により、1920 年にノーベル化学賞を受賞しました。
- ネルンストによるもう 1 つの一般的に知られている発見は、熱力学の第 3 法則です。
- 電気化学セル電位は、ネルンストの式の主な用途の 1 つです。電気化学セルは、ほとんどの種類のバッテリーを駆動するものです!これらのセルは、ジュエリーに金をメッキするなど、材料の薄い層を他の表面にメッキするためにも使用できます。
さらに読む
- 電解セルと電気分解
- ボルタ電池とガルバニ電池
- 標準削減の可能性
- 平衡定数
- ギブスの自由エネルギー
- ブラウン運動