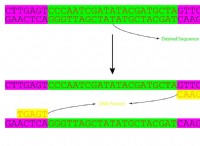
1。初期状況
* h₂so₄(硫酸): これは、水中で完全に解離する強酸であり、すべての分子に対して2つの水素イオン(H⁺)を放出します。
h₂so₄→2h⁺ +so₄²⁻
* koh(水酸化カリウム): これは、水中でも完全に解離し、すべての分子に1つの水酸化物イオン(OH⁻)を放出する強力なベースです。
KOH→K⁺ +OH⁻
2。滴定プロセス
* KOHをH₂SO₄溶液に追加すると、KOHからの水酸化物イオン(OH⁻)は、Hso₄の水素イオン(H⁺)と反応します。
*この反応は水を形成します(H₂O):
h⁺ +oh⁻→h₂o
*反応は、硫酸からのすべての水素イオン(H⁺)が水酸化カリウムからの水酸化物イオン(OH⁻)と反応するまで続きます。
3。等価点
* 中和: 等価ポイントでは、酸からのH⁺のほくろは、塩基からのOH⁻のモルに正確に等しくなります。現在、溶液は本質的に中性であり、カリウムイオン(k⁺)と硫酸イオン(so₄²⁻)のわずかな過剰しか残っていません。
* 分子レベル: すべての硫酸が中和されています。 溶液中に残っている遊離水素イオン(H⁺)または水酸化物イオン(OH⁻)はありません。反応は完了しました。
4。等価ポイントを超えて
*等価ポイントを超えてKOHを追加し続けると、ソリューションは基本になります。これは、溶液に過剰な水酸化物イオン(OH⁻)を追加しているためです。
キーポイント
* 化学量論: h₂so₄とKOHの反応は1:2モル比を持っています。これは、1モルのh₂so₄が2つのモルのKOHと反応することを意味します。
* pHの変化: 滴定中、KOHを追加すると、溶液のpHが徐々に増加します。 pHの変化は、同等のポイントの近くで最も劇的です。
* インジケーター: インジケーターは、色を変更することにより、等価点を視覚的に通知するために使用されます。インジケータの選択は、特定の滴定に依存します。
特定の側面の詳細な説明をご希望の場合はお知らせください!