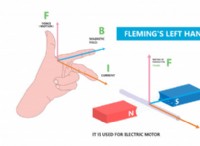
その理由は次のとおりです。
* 共有結合: 原子間の電子の共有を伴います。
* 極性: 分子内の電子密度の不均一な分布を指します。これは、結合内の1つの原子が他の原子よりも電子に対してより強い引力を持っている場合に起こります。
それがどのように機能するか:
* 電気陰性度: 原子が化学結合で自分自身に向かって電子を引き付ける能力。電気陰性度が高い元素は、電子を近づける傾向があります。
* 電気陰性度の違い: 2つの原子が電気陰性度に有意な差がある場合、電気陰性原子がより多くの部分的な負電荷(Δ-)があり、電気陰性原子が少ない場合、部分的な正電荷(Δ+)があります。
例:
* 水(h₂o): 酸素は水素よりも電気陰性です。これは、O-H結合の電子が酸素原子に近い時間を費やし、部分的な負電荷を与えることを意味します。水素原子には部分的な正電荷があります。
極性共有結合の結果:
* 双極子モーメント: 極性分子には永久的な双極子モーメントがあります。つまり、電荷の分離があります。
* 溶解度: 極性分子は、水のような極性溶媒に溶解する傾向があります。
* 分子間力: 極性分子は、非極性分子と比較して、より強い分子間力(水素結合など)を経験します。
特定の側面をより深く掘り下げたい場合はお知らせください!