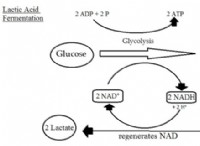
酸化と還元の理解
* 酸化: 電子の損失。電子を失う物質は酸化されていると言われています。
* 削減: 電子の増加。電子を獲得する物質は減少すると言われています。
接続
ある物質が電子を失う(酸化)、別の物質がそれらの電子を獲得する必要があります(還元)。電子の伝達のように考えてください。 他のものなしでは片方のものを持つことはできません。
酸化還元反応:全体像
酸化還元反応は化学と生物学の基本であり、次の重要な役割を果たします。
* 燃焼: 燃料燃料には、燃料の酸化と酸素の減少が含まれます。
* 腐食: 錆びは金属の酸化の例です。
* 電気化学: バッテリーは、酸化還元反応に依存して電気を生成します。
* 光合成: 植物は酸化還元反応を使用して、日光をエネルギーに変換します。
例:
亜鉛金属(Zn)と銅(II)イオン(Cu²⁺)の間の反応を考えてみましょう。
Zn(s) +cu²⁺(aq)→zn²⁺(aq) + cu(s)
* 亜鉛(Zn)が酸化されています: 2つの電子を失い、Zn²⁺を形成します。
* 銅(ii)イオン(cu²⁺)が減少します: Cuを形成するために2つの電子を獲得します。
キーテイクアウト
酸化と還元は常に結合されたプロセスです。それらは、1つの物質が酸化され、別の物質が減少する酸化還元反応で一緒に発生します。