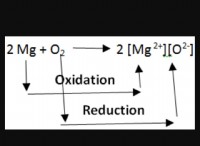
* 質量保存法則: この基本法は、閉じたシステムでは、化学反応前の反応物の総質量は、反応後の産物の総質量に等しくなければならないと述べています。
* 化学式: 重曹(重炭酸ナトリウム、NAHCO3)と酢(酢酸、CH3COOH)の反応のためのバランスの取れた化学方程式は次のとおりです。
NAHCO3 + CH3COOH→CH3COONA + H2O + CO2
この方程式は、1モルの重炭酸ナトリウムが1モルの酢酸と反応して、1モルの酢酸ナトリウム、1モルの水、および1モルの二酸化炭素を生成することを示しています。
* 化学量論: 化学量論は、化学反応における反応物と産物の間の定量的関係の研究です。使用する反応物の量に基づいて形成された各製品の量を予測することができます。
* 質量式の関係: 反応によって生成される二酸化炭素ガスの量を測定できます。二酸化炭素の密度を知ることにより、その質量を計算できます。
* 実験的証拠: 慎重な実験を通じて、反応中の反応物と生成物の腫瘤を測定できます。また、生成された二酸化炭素の量を収集して測定することもできます。これらの測定値を比較すると、質量の増加は主に生成された二酸化炭素ガスによるものであることを示しています。
キーポイント:
*質量の保存法則は、二酸化炭素のために質量の増加が *のみ *のみ *のみであることを直接証明しませんが、反応物と生成物の総質量が一定のままであることを確認します。
*化学式は、反応で形成された特定の製品を理解するのに役立ちます。
*化学量論により、二酸化炭素の質量を含む各製品の量を予測することができます。
*実験的証拠は、反応物、生成物、および収集された二酸化炭素ガスの質量を比較することにより、最も直接的な証拠を提供します。
したがって、これらの科学的原理と慎重な実験測定の組み合わせであり、重曹と酢の反応後の質量増加は主に生成された二酸化炭素から生じると結論付けることができます。