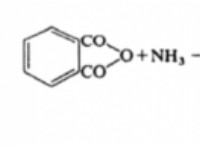
1。化学量論比:
* 反応物と生成物の間の明確な関係: 各分子の前に正確な数値係数があり、それらが反応し、生成される正確な比率を示します。例えば:
* `CH4 + 2O2→CO2 + 2H2O`は、1つのメタン(CH4)の分子が2つの酸素(O2)と反応して、二酸化炭素(CO2)の1つの分子と2つの水分分子(H2O)を生成することを示しています。
* 質量の保存: 反応物側の各元素の原子の総数は、製品側のその要素の原子の総数に等しくなります。これにより、反応中に原子が作成または破壊されることが保証されます。
2。燃焼の種類:
* 完全燃焼: 反応が二酸化炭素(CO2)と水(H2O)のみを生成する場合、完全な燃焼と見なされます。これは通常、十分な酸素供給で起こります。
* 不完全な燃焼: 反応が産物として一酸化炭素(CO)またはSOOT(炭素粒子)を生成する場合、それは不完全な燃焼です。これは、利用可能な酸素が限られている場合に発生することがよくあります。
3。エネルギーの変化:
* 発熱反応: 炭化水素燃焼反応は発熱性であり、周囲に熱を放出します。これが、メタンやプロパンなどの燃料がエネルギー生成に使用される理由です。バランスの取れた方程式は、放出された熱(ΔH値で表されることが多い)を直接示していませんが、関連するエネルギーを理解するための基礎を築きます。
4。化学への影響:
* 反応性化学量論の理解: バランスの取れた方程式により、特定の反応に関与する反応物と産物の量を予測できます。これは、産業プロセスと化学的計算にとって非常に重要です。
* 製品の予測: バランスの取れた方程式に基づいて、環境への影響(CO排出など)を評価するために不可欠な燃焼反応の潜在的な生成物を決定できます。
例:
プロパンの燃焼(C3H8)のバランスを取りましょう。
1。不均衡: `C3H8 + O2→CO2 + H2O`
2。バランスカーボン: `C3H8 + O2→3CO2 + H2O`
3。バランス水素: `C3H8 + O2→3CO2 + 4H2O`
4。バランス酸素: `C3H8 + 5O2→3CO2 + 4H2O`
通知:
*化学量論比は、プロパンのプロパン分子分子が5分子の酸素と反応し、3分子の二酸化炭素と4分子の水を生成します。
*バランスの取れた方程式は、CO2とH2Oのみが生成されるため、プロパンの完全な燃焼を強調しています。
*式は、プロパンが一般的な燃料であるため、反応の発熱性を強調しています。