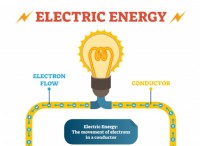
ヘンリーの法律 液体内のガスの溶解度は、液体上のガスの部分的な圧力に直接比例していると述べています。簡単に言えば、液体の上のガスの圧力が高いほど、液体にガスが溶解します。
これがこれが起こる理由の内訳です:
* 圧力力の増加ガス分子が互いに近づきます: 液体の上のガスの圧力を上げると、本質的にガス分子をより近くに絞ります。
* 液体の表面での高い濃度: この液体の表面でのガス分子の濃度の増加は、ガス分子と液体分子の間のより頻繁な衝突につながります。
* ガス溶解速度の増加: 衝突の増加により、液体に溶解するガス分子の速度が高くなります。
例:
* 炭酸飲料: 炭酸飲料のフィズは、溶解した二酸化炭素ガスによるものです。これらの飲み物を瓶詰めするために使用される高圧により、かなりの量のCO2が液体になります。ボトルを開くと、圧力が低下し、溶解したCO2が逃げて泡を形成します。
* 深海ダイビング: ダイバーがより深い深さに降りると、圧力が増加します。これにより、彼らが呼吸する空気からより多くの窒素ガスが彼らの血液に溶けます。ダイバーがあまりにも速く登ると、圧力が低下し、溶解した窒素ガスが血液中に泡を形成し、減圧病や「曲がり」と呼ばれる状態につながります。
キーポイント:
*ヘンリーの法律は、液体と化学的に反応していないガスに適用されます。
*液体中のガスの溶解度も温度の影響を受けます。一般に、ガスの溶解度は温度の上昇とともに減少します。
全体として、圧力は、液体に溶解できるガスの量を決定する上で重要な役割を果たします。この関係を理解することは、化学、生物学、工学など、多くの分野で重要です。