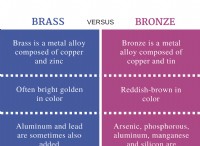
* 自由に移動: イオンは、互いに、または元の電解質分子に結合していません。彼らはソリューション全体を独立して移動することができます。
* 溶媒と相互作用: イオンは、主に水分子と相互作用し、互いではなく水分補給シェルを形成します。この相互作用は、イオンを安定化し、それらが組換えを防ぐのに役立ちます。
* 導電率に貢献: イオンの自由な移動により、ソリューションが電気を導入できます。各イオンは、全体的な導電率に独立して寄与します。
例:
テーブルソルト(NaCl)を検討してください。水に溶けると、Na+およびCl-イオンに分離します。これらのイオン:
*ソリューション全体で自由に移動します。
*水分子と相互作用し、水分補給シェルを形成します。
*溶液の導電率に貢献します。
独立行動の結果:
* 導電率の増加: 独立したイオンの動きは、非電解質溶液と比較して電気伝導率が高くなります。
* 衝突特性: イオンの独立した挙動は、浸透圧、沸点の上昇、凍結点うつ病などの衝突特性に影響します。
* 化学反応: 溶液中の遊離イオンの存在は、さまざまな化学反応を促進します。
注:
独立性の程度は、電解質の濃度と溶媒の性質によって異なります。 濃縮溶液では、イオンイオン相互作用がより重要になる可能性があります。ただし、独立した行動の一般的な原則は有効なままです。