1。バルマーシリーズを理解してください
* Balmerシリーズは、電子がn =2エネルギーレベルに終わる水素原子の遷移について説明しています。
*バルマーシリーズは可視光を生成します。
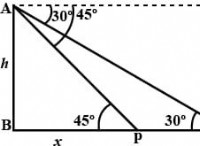
2。 Rydberg式を使用してください
Rydbergフォーミュラは、水素原子の電子遷移中に放出される光の波長を計算します。
1/λ=r(1/n 1 2 -1/n 2 2 ))
どこ:
*λは放出された光の波長です
* RはRydberg定数です(約1.097 x 10 7 M -1 ))
* n 1 エネルギーレベルが低いです(この場合、n =2)
* n 2 より高いエネルギーレベルです(この場合、初期状態、n =4)
3。波長を計算します
値をRydbergフォーミュラに差し込みます。
1/λ=(1.097 x 10 7 M -1 )(1/2 2 -1/4 2 ))
1/λ=(1.097 x 10 7 M -1 )(3/16)
λ≈4.86x 10 -7 M =486 nm
4。色を決定します
486 nmの波長は青緑色の光に対応します 。
したがって、n =4からn =2への遷移中に水素原子から放出される光は青緑です。