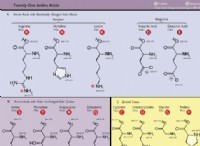
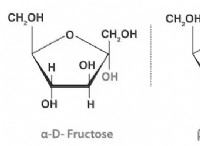
1。用語を理解する
* モラリティ(m): 臼歯は、1リットルの溶液に溶解する物質の数を示す濃度の単位です。
* 0.5 m: これは、1リットルの溶液に0.5モルのNa2HPO4が必要です。
2。必要なNa2HPO4の質量を計算します
* Na2HPO4:の分子量(モル質量)を見つけます
* Na:22.99 g/mol(x 2 =45.98 g/mol)
* H:1.01 g/mol
* P:30.97 g/mol
* O:16.00 g/mol(x 4 =64.00 g/mol)
* 総分子量:141.96 g/mol
* 0.5モルに必要な質量を計算します:
* 0.5モル * 141.96 g/mol =70.98 g
3。ソリューションを準備
* 重量70.98 gのNa2Hpo4。 バランスを使用して、必要な量を正確に測定します。
* NA2HPO4を約400 mLの蒸留水に溶解します。 溶解を容易にするために、少量の水から始めてください。
* NA2HPO4が完全に溶解するまで溶液をかき混ぜたり渦巻いたりします。 溶解を助けるために、溶液(ホットプレートまたは水浴を使用)を優しく加熱する必要がある場合があります。
* 溶解したら、溶液を500 mLの体積フラスコに慎重に転送します。
* メニスカスの底が500 mLマークに達するまで、蒸留水を体積フラスコに追加します。
* フラスコを停止し、徹底的な混合を確保するために数回反転します。
重要な考慮事項:
* 蒸留水または脱イオン水を使用: これにより、不純物が溶液の濃度に影響を与えないことが保証されます。
* Na2HPO4を慎重に処理: それは刺激物であり、皮膚や目の刺激を引き起こす可能性があります。手袋と安全ゴーグルを着用してください。
* ソリューションを適切に保存: 濃度、化学名、準備された日付、およびその他の関連情報で容器に明確にラベルを付けます。きつく密閉された容器に涼しく乾燥した場所に保管してください。
さらに質問がある場合はお知らせください!