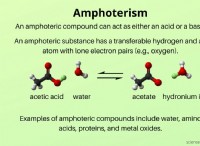
塩を不溶性にするものの内訳は次のとおりです。
* イオン結合: 不溶性塩は、主に陽イオンと陰イオンの間の強いイオン結合によってまとめられています。
* 格子エネルギー: イオン結合の強度は、化合物の格子エネルギーに寄与します。 高い格子エネルギーにより、水分子がイオンを分解し、塩を溶解することが困難になります。
* 極性: 水は極性溶媒です。つまり、正と負の端があります。極性物質とイオン化合物を弱いイオン結合で効果的に溶解します。しかし、不溶性塩は一般に極性が少ないか、非常に強いイオン結合を持っています。
* 水分補給エンタルピー: イオンが水分子に囲まれているときに放出されるエネルギーも役割を果たします。水分補給エンタルピーが低いと、イオンが溶解するとエネルギーが放出されることが少なくなり、塩が溶解するのがあまり好ましくありません。
不溶性塩の例:
* 塩化銀(AGCL): この塩は写真で一般的に使用されています。
* 硫酸バリウム(BASO4): 医療イメージングの造影剤として使用されます。
* 炭酸カルシウム(CACO3): シェル、骨、チョークで見つかりました。
* 硫化鉛(PBS): ガリーナとして知られる自然に存在するミネラル。
「可溶性」と「不溶性」という用語は相対的であることに注意することが重要です。 「不溶性」と見なされる一部の塩は、水に非常にわずかな溶解度を持っている可能性があります。つまり、わずかな量が依然として溶解する可能性があります。