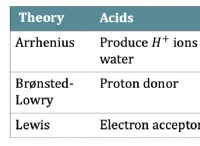
1。イオン結合: これは、1つの原子が1つ以上の電子を別の原子に透過すると発生します。結果として得られる反対に帯電したイオン(陽イオンと陰イオン)は互いに引き付けられ、イオン化合物を形成します。テーブルソルト(NaCl)を考えてください:ナトリウム(NA)は電子を失い、正に帯電するようになり、塩素(CL)はその電子を負に帯電させるようにします。それらの間の静電引力は、イオン結合を形成します。
2。共有結合: ここで、原子は電子を共有して安定した電子構成を実現します。これらの共有電子は、原子間に強い結合を生み出し、それらをまとめます。水(H₂O)は典型的な例です。各水素原子は、酸素原子と電子を共有し、安定した分子を形成します。
3。金属結合: このタイプの結合は、金属原子間で発生します。電子は非局在化されています。つまり、特定の原子に結合するのではなく、金属構造全体を通して自由に移動します。電子のこの自由な動きは、導電率や閉鎖性などの独自の特性を金属に与えます。
これらは3つの主要な方法であり、各カテゴリ内に例外とニュアンスがあることに注意することが重要です。たとえば、電子が不均等に共有される極性共有結合もあり、原子の部分的な正と負の電荷をもたらします。 しかし、これらの3つのカテゴリは、原子がどのように結合して分子と化合物を形成するかについての基本的な理解を提供します。