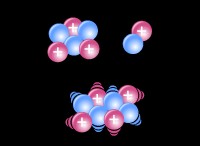
* 塩(NaCl)はイオン化合物です。 これは、静電力によって結合された正に帯電したナトリウムイオン(Na+)と負に帯電した塩化物イオン(CL-)で作られていることを意味します。
* 水(H2O)は極分子です。 これは、電子の不均一な共有のために、わずかに正の端とわずかに負の終わりを持つことを意味します。
* 塩イオンを囲む水分子。 水分子の正の端は負の塩化物イオンを引き付け、水分子の負の端は正のナトリウムイオンを引き付けます。この相互作用は、塩結晶をつなぎ合わせた結合を弱め、塩を個々のイオンに分解します。
したがって、塩イオンは水分子によって囲まれ、分離され、溶液を形成します。 それは新しい化合物ではなく、塩イオンが水全体に分散される混合物です。
ここに覚えておくべき重要なポイントがいくつかあります:
* 溶解は物理的な変化であり、化学的変化ではありません。 塩イオンはまだ存在し、互いに分離されています。
* 水を蒸発させることで塩を取り戻すことができます。 これにより、塩は固体として残ります。
* すべての物質が水に溶けているわけではありません。 オイルのような一部の物質は非極性であり、水とうまく相互作用しません。
他に質問がある場合はお知らせください!