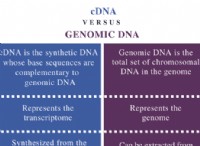
水の極性:
*水は極性分子です。つまり、電子の不均一な分布のために正と負の末端があります。
*この極性により、水分子は他の極性分子と強い水素結合を形成することができます。
溶解度ルール:
* "のように溶解するような :この原理は、極性物質が極性溶媒(水など)によく溶解し、非極性物質が非極性溶媒によく溶解することを示しています。
* 極分子: これらの分子は、電子密度の不均一な分布を持ち、部分的な正電荷と負の電荷を引き起こします。それらは、水分子と強い水素結合を形成し、溶解度を高めることができます。
* 非極性分子: これらの分子には、電子密度の分布さえあり、かなりの部分的な電荷がありません。それらは水と強い水素結合を形成することはできず、溶解性が低い傾向があります。
形状と溶解度:
* 形状は極性に影響します: 分子の形状は、その電子密度の分布を決定します。たとえば、C-O結合の双極子モーメントがキャンセルするため、CO2のような線形分子は非極性です。
* 形状と水素結合: 分子に極性結合がある場合でも、その形状は水と水素結合を形成するのを妨げる可能性があります。たとえば、Tert-Butanol(C4H10O)のような分岐分子は、その形状が水素結合を妨げるため、ストレート鎖異性体N-ブタノール(C4H10O)よりも水に溶解しません。
* 分子間相互作用: 形状は、水素結合以外の分子間力で役割を果たします。たとえば、水素結合よりも弱いロンドン分散力は、分子の表面積と形状の影響を受けます。
例:
* グルコース(C6H12O6): グルコースは、水と水素結合を形成できる多くのヒドロキシル基(-OH)を備えた極性分子です。その形状により、効率的な水素結合が可能になり、水に溶けます。
* メタン(CH4): メタンは、四面体形状の非極性分子です。水と水素結合を形成することはできず、非常に溶けやすくなります。
結論として、分子の形状を理解することで、水と水素結合を形成する能力を予測することができます。これは、その溶解度を決定する重要な要因です。