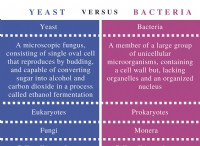
その理由は次のとおりです。
* 電子親和性 電子がその気体状態の中性原子に追加される場合のエネルギーの変化です。より負の電子親和性値は、電子を獲得する傾向が大きいことを示します。
* フッ素(f) より高い電子親和性があります 窒素(n)より。これは:
* より小さな原子サイズ: フッ素は窒素よりも小さいため、入ってくる電子は核により強く引き付けられます。
* より高い電気陰性度: フッ素は窒素よりも電気陰性度が高く、電子を引き付ける傾向が高いことを示しています。
* 半分充填p軌道: 窒素には半分充填されたp軌道があり、それがより安定しています。電子を追加すると、この安定性が破壊され、好ましくなりません。
したがって、フッ素は窒素よりも電子を獲得する傾向が強く、より負の電子親和性値をもたらします。