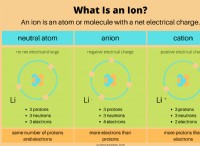
h₂co₃⇌h⁺ +hco₃⁻
これが故障です:
* 炭酸酸(H₂Co₃): 二酸化炭素が水に溶けると、弱酸が形成されます。
* 水素イオン(H⁺): 溶液の酸性度に寄与する正に帯電したイオン。
* 重炭酸塩イオン(HCO₃⁻): バッファとして機能する負に帯電したイオンは、溶液のpHを維持するのに役立ちます。
炭酸酸のイオン化は、以下を含む多くの生物学的および化学システムにおいて重要なプロセスです。
* 血液緩衝液: 重炭酸イオンは、血液のpHを維持する上で重要な役割を果たします。
* 海洋酸性化: 大気中のCO₂の濃度の増加は、海洋の炭酸酸の増加につながり、海洋酸性化として知られる現象であるpHの減少を引き起こしています。
* 炭酸塩鉱物形成: 炭酸酸は、炭酸カルシウムなどのミネラルと反応して溶存イオンを形成し、洞窟やその他の地層の形成に寄与する可能性があります。