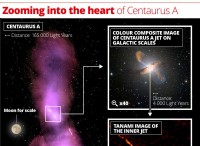
アミノ酸の一般化された構造
アミノ酸はタンパク質の構成要素です。それらはすべて、次のことで構成される共通の基本構造を共有しています。
1。中央炭素原子(α-炭素):
*この炭素原子はキラル(グリシンを除き、2つの水素原子が結合しています)であり、4つの異なるグループが付着しています。
2。カルボキシル基(-COOH):
*これは、プロトン(H+)を寄付できる弱酸性群です。
*アミノ酸の酸性の性質を担当しています。
3。アミノ基(-NH2):
*これは、プロトン(H+)を受け入れることができる弱く基本的なグループです。
*アミノ酸の基本的な性質を担当しています。
4。変数「R」グループ(サイドチェーン):
*これは各アミノ酸のユニークな部分であり、その特定の特性を与えます。
* Rグループは次のとおりです。
* 非極性: 疎水性は、タンパク質の内部に見られる傾向があります。
* 極: 親水性は、タンパク質の表面に見られる傾向があります。
* 充電: 酸性(負に帯電)または基本(正に帯電した)である場合があります。
ここに単純化された図があります:
`` `
h
|
H -C -COOH
|
r
`` `
キーポイント:
*アミノおよびカルボキシル基は通常、生理学的pHでイオン化されており、アミノ酸に正味電荷を与えます。
* Rグループの多様性は、タンパク質構造と機能の膨大な配列を可能にするものです。
*タンパク質には20の一般的なアミノ酸があります。
例:
* グリシン: Rグループは水素原子(H)です。
* アラニン: Rグループはメチル基(CH3)です。
* グルタミン酸: Rグループはカルボキシルグループ(-CH2-CH2-COOH)です
結論:
中心炭素原子とその4つの付着グループを備えたアミノ酸の一般化された構造は、タンパク質の複雑な世界の基礎を形成しています。この基本構造を理解することは、アミノ酸が互いにどのように相互作用するかを理解するために重要であり、多様な機能を備えたタンパク質を形成します。