ハイブリダイゼーション
異なる分子や化合物が異なる形状を示す理由を考えたことはありますか?中心原子と他の原子との間の結合が特定の方法で形成されるのはなぜですか?分子の形状と空間配置を変える概念とは?
さまざまな分子の形状やエネルギーなどを調整する上で重要です。では、ハイブリダイゼーションとは何ですか?結合はどのように調整されるのでしょうか?この記事では、これらの質問に答えます。
ハイブリダイゼーションとは?
これは、原子軌道を混合して、結合特性を記述するのに適した高度な混成軌道を形成するという仮説です。これにより、原子の原子価軌道のまったく新しい形状と方向が導かれます。
これは本質的に、結合と孤立電子対がある場合に電子がどこにあるかを予測する試みです。原子軌道が混ざり合って新しい原子軌道を形成するときに発生します。高度な軌道は、古い軌道と同じ電子容量を持っています。新しい混成軌道のエネルギーと特性は、混成していない元の軌道の「平均」です。
ハイブリダイゼーションの概念を導入する必要性は、メタンなどの分子内のすべての C-H 結合が区別できないという確実性を説明する最も優れた説明でした。
ハイブリダイゼーションの概念
Linus Pauling はハイブリダイゼーションの概念を導入しました。この概念は、CH4 のような 3 つ以上の原子を持つ分子の特徴的な次元形状を表します。 、H2 お、NH3 彼は、原子軌道が統合されて、混成軌道として認識される同一の軌道の新しいセットを形成することを提案しました。純粋な軌道とは異なり、混合軌道は結合の形成に利用されます。このようなエピソードはハイブリダイゼーションとして認識されます。このプロセスは、わずかに異なるエネルギーの軌道を混合して再分配することであり、その結果、同等のエネルギーと形状の軌道の新しいセットが形成されます。
ハイブリダイゼーションの種類
s、p、および d 軌道を含むさまざまなタイプのハイブリダイゼーションがあります。さまざまなタイプは次のとおりです:
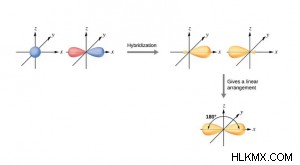
<オール>- 1 つの p 軌道と 1 つの s 軌道がブレンドされ、2 つの sp 複合 (または混成) 軌道を形成します。
- それらは等価で対称な混成軌道です。
- 各 sp 混成軌道の性質は同じです。つまり、50% の s 字と 50% の p 字です。
- 形成された分子は形状が線形であるため、結合角は 180° です。
- s 軌道は球形、p 軌道は梨形ですが、s 軌道と p 軌道が混ざった sp 混成軌道は楕円形です。
- このタイプのハイブリダイゼーションは、対角ハイブリダイゼーションとも呼ばれます。つまり、空間配置が反対方向の直線に向けられます。
- 例:BeCl2 , BeF2 、C2 H2 , BeH2 など
- sp ハイブリダイゼーション:
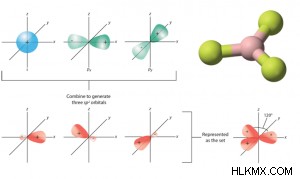
- 1 つの s 軌道と 2 つの p 軌道が融合し、3 つの sp を形成します 融合 (または混成) 軌道。
- 三方交配とも呼ばれます。
- 同じ形と同じエネルギーを持っています.
- それらは 1 つの平面にあります。
- 各 SP 混成軌道には 33% の S 字と 66% の P 字があります。
- 形成された分子は三角形の平面形状であるため、結合角は 120° です。
- sp 混成軌道は、s 軌道と 2 つの p 軌道を混合して得られます。したがって、三角形の空間配置があります。
- p 軌道の寄与が s 軌道よりも大きいため、sp の形状 したがって、混成軌道はナシに向かう傾向があります。
- 例:BeH3 , BeF3 など、およびアルケン
- sp ハイブリダイゼーション:
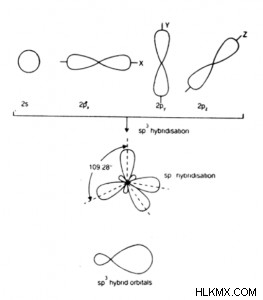
- 1 つの s 軌道と 3 つの p 軌道が混ざり合い、4 つの sp 複合 (または混成) 軌道を形成します。
- 四面体混成とも呼ばれます。
- sp 混成軌道は等価な対称混成軌道です。
- これらは同じ形と同じエネルギーを持っています.
- 各 sp 混成軌道には、4 分の 1 の s 文字と 3/4 の p 文字があります。つまり、25% の s 文字と 75% の p 文字です。
- 形成された分子は形状が四面体であるため、結合角は 109.5° です。四面体角とも呼ばれます。
- 例:H2 O, H,2 S、C2 H6 、SiCl4 、CH4 など
- sp ハイブリダイゼーション:
- 1 つの s、3 つの p、1 つの d 軌道が混ざり合って 5 つの sp を形成します d 混合 (または混成) 軌道。
- 三方両錐体混成とも呼ばれます。
- これらは同じ形と同じエネルギーを持っています.
- 形成された分子は、三方両錐体の形状であるため、水平面で 120°、垂直面で 90° の結合角を持ちます。
- それらは正五角両錐体の 5 つの角に向けられています。つまり、空間内の 5 つの混成軌道の配置は五角両錐体です。
- 例:PCl5 、SbF5 、ClF3 、XeF2 など

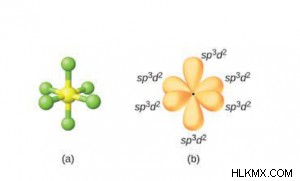
- sp 日 ハイブリダイゼーション:
- 1 つの s、2 つの d、および 3 つの p 軌道が混ざり合って 6 つの sp を形成します d 混成軌道。
- 同じ形と同じエネルギーを持っています.
- 形成された分子は八面体の幾何学的形状であるため、結合角は 90° です。
- それらは、正 (対称) 八面体、つまり、空間内の 6 つの混成軌道の八面体配置の 6 つの角に向けられています。
- 例:SF6 、SeF6 , IF5 、XeF4 など
-
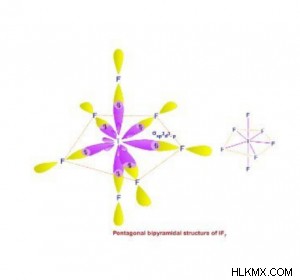
- sp 日 ハイブリダイゼーション:
- 1 つの s、3 つの p、および 3 つの d 軌道が混ざり合って 6 つの sp を形成します d 混成軌道。
- 同じ形と同じエネルギーを持っています.
- それらは正 (対称) 五角両錐体の 7 つの角に向けられています。つまり、空間内の 7 つの混成軌道の配置は五角錐体です。
- 形成された分子は、三方両錐体の形状であるため、水平面で 120°、垂直面で 90° の結合角を持ちます。
- sp を示す種の𝜎結合ペアと非共有ペアの合計 d ハイブリダイゼーションは常に 7 です。
- 例:IF7 、XeF6 , ReF7 など
チャート内のさまざまなタイプのハイブリダイゼーションを以下に示します:
| 分子タイプ | 電子対の数 | ジオメトリ | 結合角 | ハイブリダイゼーション | 例 |
| AB2 | 2 | リニア | 180° | sp | BeCl2 |
| AB3 | 3 | 三角平面 | 120° | sp | BF3 |
| AB4 | 4 | 四面体 | 109.5° | sp | CH4 |
| AB5 | 5 | 三角両錐 | 90°、120° | 速度 | PCl5 |
| AB6 | 6 | 八面体 | 90° | 速度 | SF6 |
| AB2 E | 3 | 曲がった | 120° (119°) | sp | SO2 |
| AB3 E | 4 | 三角両錐 | 109.5° (107.5°) | sp | NH3 |
| AB2 E2 | 4 | 曲がった | 109.5° (104.5°) | sp | H2 その他 |
| AB4 E | 5 | シーソー | 180°、120° (173.1°、101.6°) | 速度 | SF4 |
| AB3 E2 | 5 | T型 | 90°、180° (87.5°、<180°) | 速度 | ClF3 |
| AB2 E3 | 5 | リニア | 180° | 速度 | XeF2 |
| AB5 E | 6 | 四角錐 | 90° (84.8°) | 速度 | BrF5 |
| AB4 E2 | 6 | 正方形平面 | 90° | 速度 | XeF4 |
| AB7 | 7 | 五角両錐 | 90°、180° | 速度 | XeF6 |
ハイブリダイゼーションの必要性
たとえば、BeCl2 ハイブリダイゼーションの必要性を理解するための分子。
ベリリウム (Be) の基底状態配置は 1s 2s です。
ですから、2 つの結合を形成するために、励起状態になり、
Be- 1s 2s 2p
この状態では、Be は 2 つの Cl と結合を形成できますが、結合は等しくありません (同一)。これは、Be の球状の 2s 軌道と Cl のダンベル型の 3p 軌道が 1 つの結合で重なるためです。対照的に、もう一方の結合は、Cl のダンベル型軌道と重なる Be のダンベル型 2p 軌道で構成されます。
しかし、BeCl2 の実際の形状は 分子は線形で等しいです。これは、両方の Be-Cl 結合の結合長とエネルギーが同じであることを意味します。この矛盾はハイブリダイゼーション理論によって解決されました。したがって、分子のハイブリダイゼーションの必要性が生じます。
結論
上記の議論から、ハイブリダイゼーションとは何か、さまざまなタイプ、チャートなどの質問に精通しています。これは、異なる原子間の化学結合を説明する非常に便利な方法です.
簡単に言えば、2 つ以上の縮退した原子軌道が混ざり合って新しい軌道のセットを形成する現象です。そして、さまざまな種類の交配を覚えるために、図表が最善の方法です。
よくある質問
Q1. ハイブリダイゼーションの顕著な特徴は何ですか?
答え: ハイブリダイゼーションの主な特徴は次のとおりです:
<オール>Q2. ハイブリダイゼーションの重要な条件は?
答え: ハイブリダイゼーションの重要な条件は次のとおりです。
<オール>Q3. 分子のハイブリダイゼーションを決定する要因は何ですか?
答え: 分子のハイブリダイゼーションを決定する 3 つの重要な要因があります。これらは:
- 𝜎結合の数: 𝜎結合は、分子の形状形成において重要な役割を果たします。これらの絆は 𝜋 絆よりも強力です。
- 孤立ペアの数: 孤立電子対は、分子の空間的な向きを決定します。例えばH2の場合 おお、ハイブリダイゼーションはsp .しかし、lp-lp 反発により、結合角は 109.5° から 104.5° に減少しました。
- 𝜋結合は非混成軌道から生じます。
Q4 オービタル ハイブリダイゼーションとは何ですか?
答え: 原子価結合理論によると、軌道混成は、原子軌道を組み合わせて、電子を対にして化学結合を形成するのに理想的な新しい混成軌道を作成するプロセスです。