アボガドロの法則は、理想気体の法則の特定のバージョンです。それは、理想気体の等しい温度で等しい体積はすべて同じ数の分子を持っていると言います.このアボガドロの法則の例の問題は、アボガドロの法則を使用して、特定のボリューム内のモル数または特定のモル数のボリュームを見つける方法を示します。
アボガドロの法則の例

質問: 3 つの気球には異なる量の理想気体が充填されています。 1つの風船に3molの理想気体を入れると30Lになります。
a) 1 つの風船には 2 モルのガスが含まれています。風船の体積は?
b) 1 つの風船には 45 L の体積が入っています。風船には何モルのガスが入っていますか?
解決策:
アボガドロの法則によると、体積 (V) は同じ温度での気体の分子数 (n) に正比例します。
n ∝ V
これは、V に対する n の比率が定数値に等しいことを意味します。

この定数は決して変わらないため、ガスの量と体積が異なる場合、比率は常に真になります。

どこ
ni =分子の初期数
Vi =初期ボリューム
nf =分子の最終的な数
Vf =最終巻。
パート a) 1 つのバルーンには 30 L に 3 モルのガスが含まれています。もう 1 つのバルーンには未知の体積に 2 モルのガスが含まれています。これらの値を上記の比率に当てはめます:
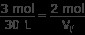
Vf を解く
(3 mol)Vf =(30 L)(2 mol)
(3 mol)Vf =60 L·mol
Vf =20L
ガスの量が少ないほど、体積が小さくなることが予想されます。この場合、2 モルのガスは 20 L しか占めません。
パート b) 今回は、もう一方のバルーンの体積は 45 L で、モル数は不明です。以前と同じ比率で開始します:

パート a と同じ既知の値を使用しますが、Vf には 45 L を使用します。
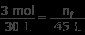
nf について解く
(3 mol)(45 L) =(30L)nf
135 mol·L =(30L)nf
nf =4.5モル
体積が大きいということは、バルーン内により多くのガスがあることを意味します。この場合、大きな風船には 4.5 モルの理想気体があります。
別の方法は、既知の値の比率を使用することです。パート a では、既知の値はモル数でした。 ⁄3 の 2 番目のバルーンがありました モル数 ⁄3 巻の最終的な答えは ⁄3 です 既知のボリューム。 bの部分も同様です。最終体積は 1.5 倍大きいので、1.5 倍の分子を持つ必要があります。 1.5 x 3 =4.5 で、私たちの答えと一致します。これは、自分の作業を確認するのに最適な方法です。