キセノンは、原子番号 54 と元素記号 Xe を持つ化学元素です。この要素は希ガスであるため、不活性、無色、無臭、無味、無毒です。キセノンは、高出力ランプでの使用で最もよく知られています。これは、興味深いキセノンの事実のコレクションと、その発見、使用、およびソースの歴史です.
キセノン元素の事実
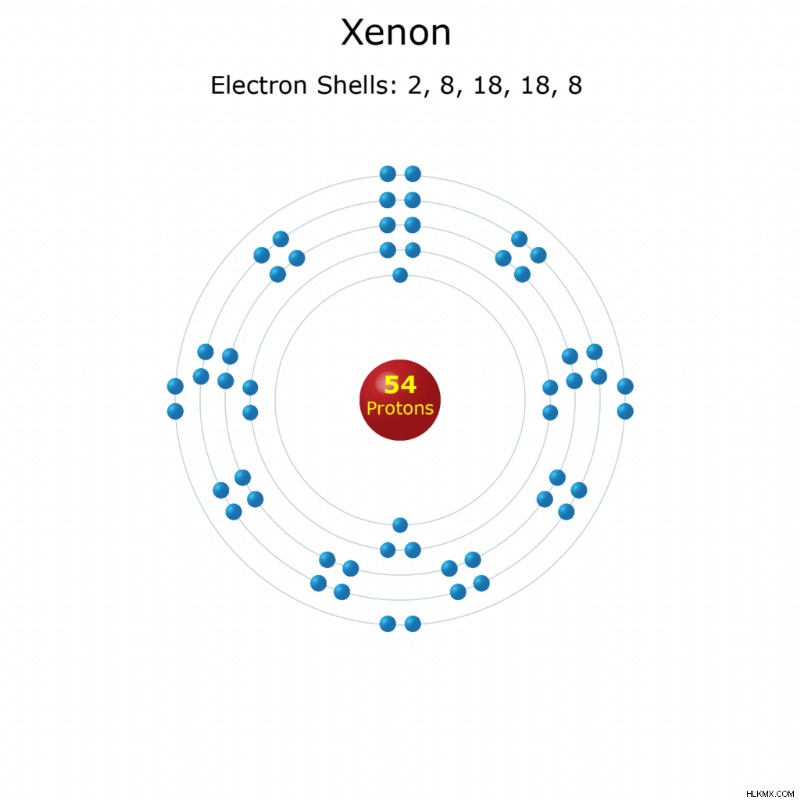
名前 :キセノン
原子番号 :54
元素記号 :セ
外観 :無色ガス
グループ :グループ 18 (希ガス)
期間 :ピリオド5
ブロック :pブロック
エレメント ファミリー :希ガス
原子質量 :131.293(6)
電子配置 :[Kr] 4d 5s 5p
シェルあたりの電子数 :2、8、18、18、8
発見 :ウィリアム・ラムゼイとモリス・トラバーズ (1898)
名前の由来 :ギリシャの xenos 、見知らぬ人を意味します
発見の歴史
スコットランドの化学 ウィリアム・ラムゼイと英国の化学者モリス・トラバーズは、1898 年 9 月にキセノンを分離して発見しました。彼らはすでに、実業家ルートヴィヒ・モンドから贈られた液体空気機械を使用して、希ガスのクリプトンとネオンを発見していました。液化空気を蒸発させ、残留物を調べることによって得られたキセノン。ガスを真空管に入れると、見事な青い輝きが観察されました。ラムゼイは、「奇妙な」を意味するギリシャ語の「xenos」から新しい要素の名前を提案しました。ラムゼイは、液化空気のサンプルでキセノンを見知らぬものとして説明しました.
キセノン同位体
天然キセノンは、Xe-126、Xe-128、Xe-129、Xe-130、Xe-131、Xe-132、および Xe-134 の 7 つの安定同位体で構成されています。 Xe-126 と Xe-134 は、理論的には二重ベータ崩壊を起こしますが、観測されたことはありません。 40 以上の放射性同位元素が記載されています。最も長寿命の放射性同位元素は Xe-124 で、半減期は 1.8 × 10 年です。
生物学的役割と毒性
キセノン元素は無毒であり、生物学的役割を果たしません。しかし、キセノンは血液に溶け、血液脳関門を通過し、麻酔薬として作用します。キセノンと酸素の混合物を呼吸することは可能ですが、キセノンは酸素より重いため、窒息する可能性があります。キセノン化合物、特に酸素キセノン化合物は、有毒で爆発する可能性があります。
キセノンの供給源
キセノンは地球の大気中の希ガスで、約 1150 万分の 1 (0.087 百万分の 1) の濃度で存在します。まれではありますが、元素の最良の供給源は液体空気からの抽出です。キセノンもほぼ同じ濃度で火星の大気中に存在します。この要素は、太陽、隕石、木星で発見されています。長い間、科学者たちは大気が地球上のキセノンの唯一の発生源であると考えていましたが、大気中の濃度は地球で予測された量と一致しませんでした。研究者は、ガスがいくつかの鉱泉から放出されることを発見したため、キセノンも地球内に存在します。いわゆる「失われたキセノン」が地球のコアで発見され、おそらく鉄とニッケルに結合している可能性があります.
キセノンの使用
キセノンは、写真用フラッシュ、自動車のヘッドランプ、ストロボ、殺菌灯などのガス放電ランプに使用されます (スペクトルには強い紫外線成分が含まれるため)。そのスペクトルは自然太陽光のスペクトルに近いため、映画プロジェクトのランプやハイエンドの懐中電灯に使用されています。近赤外線を放出するため、暗視システムで使用されます。キセノンとネオンの混合物は、プラズマ ディスプレイの構成要素です。
最初のエキシマ レーザーは、キセノン ダイマー (Xe2 )。キセノンは、いくつかのタイプのレーザーで一般的な元素です。
医学では、キセノンは全身麻酔薬、神経保護剤、心臓保護剤です。赤血球の生産とパフォーマンスを向上させるためにスポーツ ドーピングで使用されます。同位体 Xe-133 は単一光子放出コンピューター断層撮影で使用され、Xe-129 は磁気共鳴画像法 (MRI) の造影剤として使用されます。一部の皮膚科の処置には、塩化キセノン エキシマ レーザーが使用されます。
キセノンは核磁気共鳴 (NMR) にも使用され、表面の特性評価を支援します。気泡チャンバー、熱量計、およびイオン推進推進剤として使用されます。
キセノン化合物
希ガスは比較的不活性ですが、いくつかの化合物を形成します。ヘキサフルオロ白金酸キセノンは、これまでに合成された最初の希ガス化合物でした。塩化物、フッ化物、酸化物、硝酸塩、金属錯体など、80 を超えるキセノン化合物が知られています。
物理データ
密度 (STP で): 5.894g/リットル
融点: 161.40 K (−111.75 °C、 −169.15 °F)
沸点: 165.051 K (−108.099 °C、 −162.578 °F)
トリプルポイント: 161.405K、 81.77kPa
重要なポイント: 289.733K、5.842MPa
20ºC での状態: ガス
融合の熱: 2.27kJ/モル
気化熱: 12.64kJ/モル
モル熱容量: 21.01 J/(モル・K)
熱伝導率: 5.65×10W/(m・K)
結晶構造: 面心立方 (fcc)
磁気注文: 反磁性
原子データ
共有半径: 140±午後9時
ファン デル ワールス半径: 午後216時
電気陰性度: ポーリングスケール:2.6
1 イオン化エネルギー: 1170.4kJ/モル
2 イオン化エネルギー: 046.4kJ/モル
3 イオン化エネルギー: 3099.4kJ/モル
一般的な酸化状態: 通常は 0 ですが、+1、+2、+4、+6、+8 の場合もあります
楽しいキセノンの事実
- キセノンは空気より密度が高いため、深い響きの声を出すことができます (ヘリウムの反対)。ただし、キセノンは麻酔薬であるため、この目的で使用されることはあまりありません。
- 同様に、気球にキセノン ガスを充填すると、気球は床に沈みます。
- キセノンの気体、液体、固体は無色ですが、元素の金属固体状態は空色です。
- (福島の原子炉からのような) 核分裂は、放射性同位体ヨウ素 135 を生成することができます。ヨウ素 135 はベータ崩壊を受け、放射性同位体キセノン 135 を生成します。
参考文献
- バートレット、ニール (2003)。 「希ガス」。 化学および工学ニュース .アメリカ化学会。 81 (36):32–34. doi:10.1021/cen-v081n036.p032
- ブロック、デビッド S.;シュロビルゲン (2011)。 「キセノンの欠けた酸化物、XeO2の合成 、および地球の失われたキセノンに対するその影響。」 J.午前。化学。社会 2011, 133, 16, 6265–6269. doi:10.1021/ja110618g
- グリーンウッド、ノーマン N.;アーンショウ、アラン (1997)。 元素の化学 (第 2 版)。バターワース・ハイネマン。 ISBN 0-08-037941-9.
- Meija, J.;ら。 (2016)。 「元素の原子量 2013 (IUPAC テクニカル レポート)」。 純粋化学と応用化学 . 88 (3):265–91. doi:10.1515/pac-2015-0305