一般的に、学生は重曹と洗濯ソーダを混同します。これらは、2 つの異なる化合物の一般名です。 1 つは炭酸ナトリウム、もう 1 つは炭酸水素ナトリウムです。
さて、炭酸ナトリウム、重曹、洗濯ソーダはどれ?これに答えられますか?それとも、あなたもそれらの間で混乱していますか?炭酸ナトリウムの式は何ですか?炭酸水素ナトリウムの式とは?
このセクションでは、炭酸ナトリウムとその特性と用途について説明します.
炭酸ナトリウムとは
炭酸ナトリウムはFDA承認の食品添加物です。ソーダ灰、洗濯ソーダ、炭酸ナトリウム、またはソーダ結晶と呼ばれることもあります。炭酸ナトリウム、またはソーダ灰は、多くの製造プロセスで一般的な成分です。
炭酸ナトリウムは、人工的に製造することもできる天然化合物です。炭酸ナトリウムは、食料品店、プール用品店、金物店で簡単に入手できます。
炭酸ナトリウムは、適度に強い塩基として使用される無機化合物です。これは、洗濯石鹸やその他の多くの家庭用品の重要な構成要素です。
炭酸ナトリウムの式と構造
炭酸ナトリウム式 Na₂CO₃ は、炭酸の二ナトリウム塩です。炭酸ナトリウムのモル質量は 106.0 g/mol です。イオン性化合物です。これは、炭酸陰イオン (CO3-) と 2 つのナトリウム陽イオン (Na+) を含みます。結晶十水和物構造を持っています。
炭酸ナトリウムの構造を以下に示します:
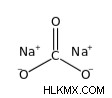
炭酸ナトリウム水和物
通常、炭酸ナトリウムは三水和物と無水塩の状態で存在します。これらの状態は
1.ナトロン:
炭酸ナトリウム十水和物です。その化学式は Na₂CO₃・10H₂O です。容易に結晶化して一水和物を形成します。
2.サーモナトライト:
炭酸ナトリウム一水和物です。その化学式は Na₂CO₃・H₂O です。結晶炭酸塩とも呼ばれます。
3.炭酸ナトリウム七水和物:
それは鉱物の形で知られていません。その化学式は Na₂CO₃・7H₂O です。
4.亜硝酸塩:
無水炭酸ナトリウムで、か焼ソーダとも呼ばれます。水和物を加熱すると、それが形成されます。ナトリウムライトを得る別の方法は、炭酸水素ナトリウムを加熱することです.
炭酸ナトリウムの合成
炭酸ナトリウムの合成には、マイニング法、バリラと昆布法、ルブラン法、ホウス法、ソルベイ法の 5 つの方法があります。
これら 5 つの方法の中で、ソルベイ法は、炭酸ナトリウムの合成に最も商業的に使用されている方法です。
ソルベイのプロセス:
工業化学者であるベルギーのエルネスト・ソルベイは、1861 年に炭酸ナトリウムを製造する方法を開発しました。 Solvay プロセスの手順は次のとおりです
ステップ 1:炭酸水素ナトリウムの製造:
この工程では、アンモニア、塩化ナトリウム、および水を用いて、炭酸水素ナトリウムおよび塩化アンモニウムを製造する。起こる化学反応は
NaCl + NH₃ + CO₂ + H₂O → NaHCO₃ + NH4Cl
ステップ 2:炭酸ナトリウムの製造:
この工程では、工程1からの式NaHCO3の炭酸水素ナトリウムを加熱することにより、それを炭酸ナトリウムに変換する。このステップで水と二酸化炭素が放出されます。
2NaHCO₃ → Na₂CO₃ + H₂O + CO₂ ↑
ステップ 3:アンモニアのリサイクル:
ステップ 1 で生成された塩化アンモニウムは石灰で処理され、残りの二酸化炭素生成物はステップ 2 にあります。起こる反応は次のとおりです。
2NH₄Cl + CaO → 2NH₃ + CaCl₂ + H₂O
生成されたアンモニアは、ソルベイ プロセスでリサイクルされます。 Solvay プロセスの唯一の廃棄物は塩化カルシウムであり、塩水と石灰石が唯一の消費物質です。その結果、このプロセスは他のプロセスよりも大幅に経済的になります。
炭酸ナトリウムの物性
環境には天然炭酸ナトリウムと人工炭酸ナトリウムがあります。当然のことながら、乾燥地帯、特に周期的な湖水が蒸発するときに見られる鉱床で発生します。
それは、二塩溶液であるトロナから作られています。炭酸ナトリウムのその他の物理的性質は
- 白色の結晶性固体です。
- 炭酸ナトリウムのモル質量は 105.99 g/mol です。
- 無味無臭で、水によく溶けます。
- Na₂CO₃ の沸点は 1600°C ですが、851°C で分解します。
- 赤色リトマスを青色に変えるので、塩基性またはアルカリ性です。
- 炭酸ナトリウムの密度は 2.54 g/cm³ です。
- 数少ない水溶性金属炭酸塩の 1 つです。
- めったに見られない形態の 1 つは、亜硝酸塩と呼ばれます。
炭酸ナトリウムの化学的性質
炭酸ナトリウムのいくつかの主な化学的性質は
1. 熱の影響:
無水炭酸ナトリウムに熱の影響はありません。崩壊せずに 852°C で溶けます。
2. 加水分解の影響:
加水分解中、OH- イオンが溶液中に放出されます。これらのイオンは、炭酸ナトリウム溶液をわずかにアルカリ性にします。
Na₂CO₃ + 2H₂O → H₂CO₃ + 2Na⁺ + 2OH⁻
3. 二酸化炭素の影響:
炭酸ナトリウム水溶液は二酸化炭素を吸収し、炭酸水素ナトリウムを生成します。
Na₂CO₃ + H₂O + CO₂ → 2NaHCO₃
4. 植物酸の効果:
ライム ジュースのような弱酸が炭酸ナトリウムと反応すると、二酸化炭素が形成されます。
Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂
- けん化による洗浄力があり、脂肪やグリースを水と混和させます。
炭酸ナトリウムの用途
1。軟水化:
炭酸ナトリウムは、Ca²⁺、Mg²⁺、および硬水にするその他のイオンを除去することにより、水を軟化させます。これらすべてのイオンを炭酸イオンで処理すると、不溶性の固体沈殿物が形成されます。さらに、軟水には多くの利点があります。石鹸の無駄を減らし、パイプと付属品の寿命を延ばし、錆から守ります。
2.ガラス製造:
ガラスの製造にはソーダ灰と苛性ソーダが必要です。炭酸ナトリウム Na₂CO₃ は、シリカフラックスとして機能します。特殊な材料を使用せずに混合物の融点を下げ、安価に「ソーダライム ガラス」を実現します。
3.食品添加物と調理:
炭酸ナトリウムは、固化防止剤、酸性度調整剤、安定剤、および膨張剤として機能する食品添加物です。さまざまな料理の用途があります。味を良くするために一部の食品にも添加されます。
4.その他の用途:
粘土を押し出すのに必要な水の量を減らすために、レンガ産業で湿潤剤として使用されます。多くのドライ ソープ パウダーには、Na₂CO₃ が含まれています。さらに、歯磨き粉の発泡剤および研磨剤としても機能します。また、さまざまな用途で強力なベースとしても使用されます。
まとめ
炭酸ナトリウムとは何?要するに、炭酸ナトリウムは、化学式Na₂CO₃を持つ炭酸の二ナトリウム塩です。炭酸ナトリウムのモル質量は 105.99 g/mol です。炭酸ナトリウムを合成するには 2 つの方法があります。
業務用はもちろん、ご家庭でも様々な用途でお使いいただけます。石鹸、ガラス、その他の化学薬品の製造に使用されます。また、pH 調整剤としても機能します。
低濃度の炭酸ナトリウムは皮膚に害を及ぼすことはありませんが、炭酸ナトリウムの水溶液は非常に反応性が高く、腐食性があります.重大な皮膚および眼への刺激を引き起こす可能性があります。そのため、注意して安全に取り扱う必要があります。
よくある質問
1.炭酸ナトリウム中毒の症状は?
A. 炭酸ナトリウムは少量であれば無害ですが、多すぎると中毒を起こすことがあります。炭酸ナトリウム中毒の症状には、
- 呼吸の問題
- 嘔吐
- 下痢
- 低血圧
- 目の刺激
したがって、注意して取り扱ってください。
2.炭酸ナトリウムは有毒ですか?
A. 皮膚に付着しても基本的に無害です。ただし、炭酸ナトリウムで作られた溶液は腐食する可能性があります。少量なら無害ですが、多すぎると中毒を起こすことがあります。それでも、ほとんどの場合、炭酸ナトリウムは毒性のリスクが低い.
3.炭酸ナトリウムを経口摂取するとどうなりますか?
A. 炭酸ナトリウムを摂取しても、体にナトリウムの負荷がかかることはありません。あなたの摂取量でさえ、あなたの食物中のナトリウムの量よりもはるかに少ない.炭酸ナトリウムを経口摂取すると、体内の水分と混ざり、制酸剤として働きます。胃の中の胃酸を中和してくれます。しかし、この目的のために処方されることは一般的ではありません.
4.腐食を防ぐために飲料水に加える炭酸ナトリウムの量はどれくらいですか?
A. 炭酸ナトリウムは、多くの場合、水の pH とアルカリ度を変えるためにある程度の量で水に添加されます。通常、防食工程で1ppmから40ppmの範囲で添加されます。この量は、食べ物や飲み物に含まれる自然量に比べれば微々たるものです.
5.炭酸ナトリウム製造のルブラン プロセスにはどのような手順が含まれますか?
A. この製造プロセスでは、3 つのステップが行われます。これらは
ステップ 1: 塩化ナトリウムは硫酸で処理されます。
2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl
ステップ 2: 硫酸ナトリウムは石炭で加熱されます。
Na₂SO₄ + 2C → Na₂S + 2CO₂
ステップ 3: この最終ステップでは、硫化ナトリウムと炭酸カルシウムが処理されます。
Na₂S + CaCO₃ → Na₂CO₃ + CaS
6. Solvay プロセスに関係する材料は何ですか?
A. ソルベイ プロセスで使用される主要な材料は、安価で簡単に入手できます。彼らは
<オール>NaCl は、炭酸ナトリウムの生成中に Na+ イオンを提供します。ブラインは地球上で豊富に利用できます。海と内陸の両方から簡単に採取できます。
- 石灰岩、または炭酸カルシウム:
CaCO3 は、Na2CO3 の製造において CO3- イオンを提供します。採掘から容易に入手できます。
- アンモニア:
NH₃ は、ハーバーのプロセスによって工業的に作られています。高価ですが、ソルベイ プロセスでリサイクルできます。