コア コンセプト
エネルギーの移動と移動を扱う熱力学の 3 つの基本的な法則があります。このチュートリアルでそれらについて学びましょう。
システムとは
熱力学の 3 つの法則を掘り下げる前に、システムと環境の概念を理解することが重要です。
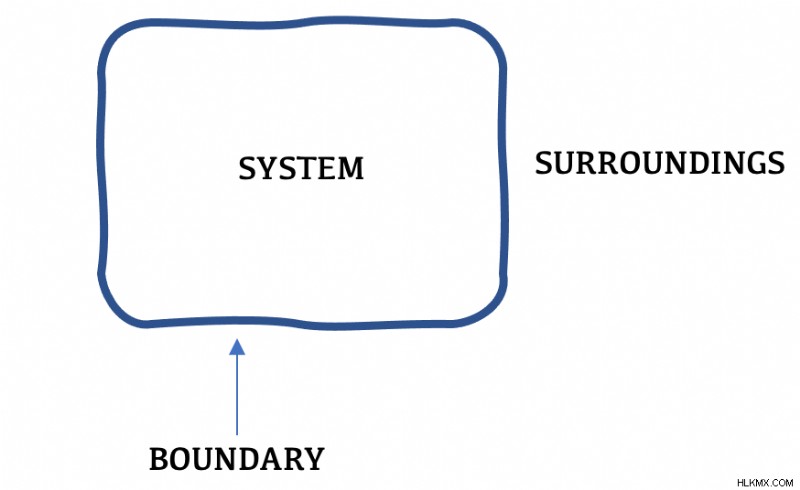
明確な境界線を引くと、熱力学がはるかに簡単になります。境界内にあるものを「システム」、境界外にあるものを「周辺」と呼びます。境界線図が描かれると、エネルギーの移動と伝達は フロー によって特徴付けられます。 システムの境界を越えて .
「宇宙」という言葉は、すべてを包括しています。つまり、システムと環境の両方を指します。
システムの種類
法律や取引所の種類によって、開放系、閉鎖系、孤立系の 3 種類の系が存在します。まず、開放系では、物質とエネルギーの交換が行われます。次に、閉じたシステムでは、物質の交換はありませんが、エネルギーの交換があります。最後に、開放系では、物質とエネルギーの両方が交換されます。これらのシステムの違いを理解することは、熱力学の法則を理解する上で非常に重要です。

熱力学とは
熱力学は、仕事、熱、温度、およびエネルギーの間の関係を扱う物理学の一分野です。さらに、熱力学は、熱エネルギーがエネルギーの形態間でどのように変換されるか、および熱エネルギーが物質にどのように影響するかについての科学を調べます。熱エネルギーは、熱から生じるエネルギーとして定義されます。
熱力学の法則:最初
熱力学の第一法則は次のように要約されます:エネルギーは生成または破壊できません .言い換えれば、宇宙の総エネルギーは一定、つまり保存されていなければなりません.
ΔUユニバース =0
ただし、エネルギーにはさまざまな形があることに注意することが重要です。第 1 法則を言い換える別の方法は、エネルギーの変化は、システム全体の熱流 (Q) に、システムまたはシステムによって行われた仕事 (W) を加えたものに等しいということです。
ΔEシステム =Q + W
∂E = ∂ Q + ∂ W 微分形式で
したがって、熱と仕事は、システムの内部エネルギーを変更できる2つのプロセスです。システムに熱が流れ込む場合、Q は正です。これは、システムによって熱が得られ、同じ大きさの熱が周囲によって失われることを意味します (吸熱反応)。熱がシステムから流出すると、Q は負になります。これは、システムによって失われる熱が、周囲から得られる熱と同じ大きさであることを意味します (発熱反応)。
仕事も同じ考えです。周囲がシステム上で機能する場合、作業はポジティブです。システムがその周囲で機能する場合、仕事は負です。いずれにせよ、総エネルギーは保存されたままです。これを以下に要約します:

熱力学の法則:第二
熱力学の第二法則はエントロピーを扱い、第一法則をある程度制限します。第 2 法則によれば、自発的なプロセスのエントロピーは増加しなければならず、孤立したシステムとしての宇宙のエントロピーは常に増加しなければなりません。これは、最大エントロピーを達成することは、システムが平衡状態にあることを意味するためです。すべてのシステムは常に平衡に達しようとしており、ギブス自由エネルギーを増加させています。
ΔSユニバース> 0
プロセスはシステムのエントロピーを減少させることができますが、その場合、周囲のエントロピーは増加します。これは第 2 法則に違反しません。
ΔSユニバース =ΔSシステム + ΔS周囲
自発的なプロセス
自発的なプロセスとは、なしで発生するプロセスです。 任意の入力。熱力学の第 2 法則によると、自発的なプロセスでは、エントロピーが増加する必要があります。エントロピーは、平衡に達すること、またはシステムの無秩序の増加として理解できます。
自発的なプロセスの例は、熱い物体から冷たい物体への熱移動です。システム全体が均一な温度に到達しようとしているため、熱は外部入力なしで自然に高温から低温に移動します。
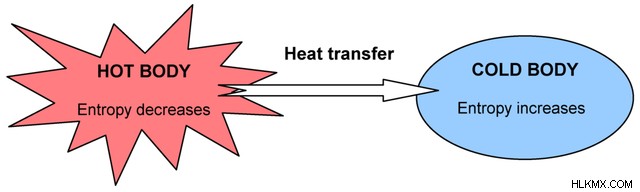
熱が高温の系から出るとエントロピーが減少し、低温の系に入るとエントロピーが増加します。これは自発的なプロセスです。
一方、非自発的なプロセスは、エントロピーが減少するプロセスです。
自発性は速度を指すものではないことに注意してください。これは、干渉なしに自然に発生するプロセスを指します。自発的なプロセスは、実際には反応速度が非常に遅い場合があります。
熱力学の法則:その 3
熱力学の第 3 法則は、温度が絶対零度に近づくにつれて系のエントロピーが一定値に近づくことを示しています。この法則は一般に、完全な結晶構造の純粋な物質に適用されます。これは、最小のエネルギーでエントロピーがゼロに近づくことができるためです。結晶が完全でない場合、または 0 K でない場合、乱れにつながる熱運動が発生します。チュートリアル

さらに読む
ヘスの法則方程式
結合エンタルピーと結合エネルギー
化学元素