アレニウス方程式 - コア コンセプト
このチュートリアルでは、アレニウスの式とは何か、この式を使用して反応の活性化エネルギーまたは速度定数を決定する方法、およびその導出方法を学習します。アレニウスの式を使用することは、化学反応速度論における重要な概念です。
アレニウス方程式とは?
アレニウスの式は、化学反応の活性化エネルギーまたは速度定数を決定するために使用されます。温度が変化するので。温度が変化したときに速度定数がどのように変化するかを知りたい場合は、アレニウスの式が役に立ちます。
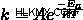
どこ 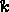 は速度定数、
は速度定数、  は活性化のエネルギー(反応を起こすのに必要なエネルギー)、
は活性化のエネルギー(反応を起こすのに必要なエネルギー)、 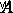 は頻度係数、
は頻度係数、 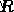 はガス定数で、
はガス定数で、 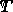 は温度です。
は温度です。
アレニウス方程式の導出
アレニウスの式は、実験データから導き出すことができます。方程式を y=mx+b の形式に線形化すると、
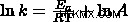
今、私たちは解決したい 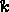
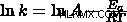
自然対数を取り除くために両辺を e に上げます
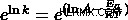
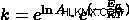
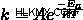
2 つの温度入力が与えられた場合、別の形式の方程式を使用できます。
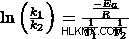
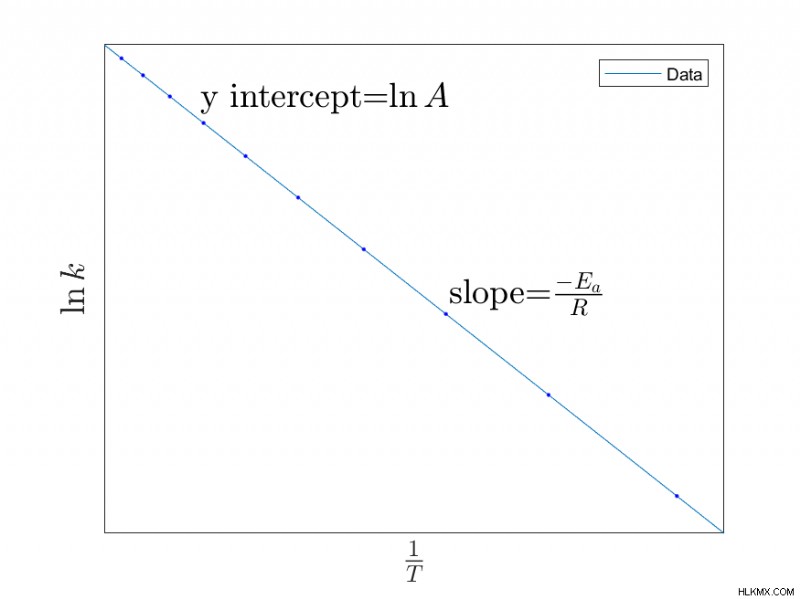
アレニウス方程式の可視化
前の方程式をプロットすることにより、反応の属性を見つけることができます。たとえば、プロットによる線形化された関数のグラフ化  vs.
vs.  で、勾配を決定できます。
で、勾配を決定できます。 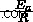 およびアレニウス定数
およびアレニウス定数 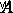 、y 切片になります。
、y 切片になります。
アレニウス方程式の問題例:
化学反応の速度定数 k は、2 つの異なる温度で測定されます。
k1 =摂氏 425 度で 1.2 x 10
k2 =摂氏 538 度で 1.4 x 10
この化学反応の活性化エネルギーを計算してください。
解決策:
2 つの温度入力が与えられているため、方程式の 2 番目の形式を使用する必要があります。
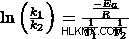
まず、273.15 を追加して、摂氏温度をケルビンに変換します。
摂氏 425 度 =698.15 K
摂氏 538 度 =811.15 K
それでは、すべての値をプラグインしましょう。 k1 =1.2 x 10 および k2 =1.4 x 10 これで T 値が得られました。
ln((1.2 x 10)/(1.4 x 10))=(-Ea /(8.31 J/Kmol))((1/698.15 K)-(1/811.15 K))
-Ea =-6735
Ea =6735 J/mol
問題例 2:
分解反応 2NO2(g) —–> 2NO(g) + O2(g) Ea を持っています 1.14 x 10 J/mol と 500 K で 7.02 x 10 L/mol x s の速度定数。どの温度で速度が 2 倍になりますか
別の変数について解くように求められた場合、作業を確認する方法がいくつかあります。速度定数 k が大きいほど、常に温度が高くなります。活性化エネルギーは常に正の符号を持つ必要があります。反応速度と速度定数は、他のすべての要因が一定に保たれている限り、温度が高いほど大きくなります。
解決策
反応速度が 2 倍の場合、k2 =2k1 =(7.02 x 10 L/mol x s) x 2 =1.40 x 10 L/mol x s
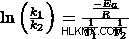
ln((1.40 x 10 L/mol x s)/(7.02 x 10 L/mol x s))=((1.14 x 10 J/mol)/8.314 J/mol x K) x ((1/500K)-(1 /T2 )
0.69029=13712 K x (0.00200 K-1/T2) )
0.00195 x 10 K =1/T2
T2 =513K
豆知識/追加情報
- アレニウス方程式を生成するために使用されるデータのグラフはアレニウス プロットと呼ばれ、X 軸は 1/T、Y 軸は k の自然対数です。勾配は -Ea です /R.
- この式は、スウェーデンの化学者 Svante Arrhenius にちなんで名付けられました 1889 年に反応速度と温度の関係を発見した
引用:
シルバーバーグ、そしてアマティス。 化学:物質と変化の分子的性質 <強い>。第 8 版、McGraw-Hill、2018 年。