ラザフォード モデルの定義
ラザフォード原子モデルには 2 つの主要な部分があります。原子核と、電子が占める原子の残りの空間です。
モデルによると、原子核は原子の体積のごく一部です。それは原子の中心にある小さなスペースを占めています。陽子と中性子は原子核を構成し、原子の化学的性質を定義します。
ラザフォードはまた、彼のモデルの中で、太陽の周りを回転する惑星のように、電子が設定された軌道で原子核の周りを回転すると主張しました。前のセクションで説明したように、理論のこの部分は不正確でした。

ラザフォードの金箔実験
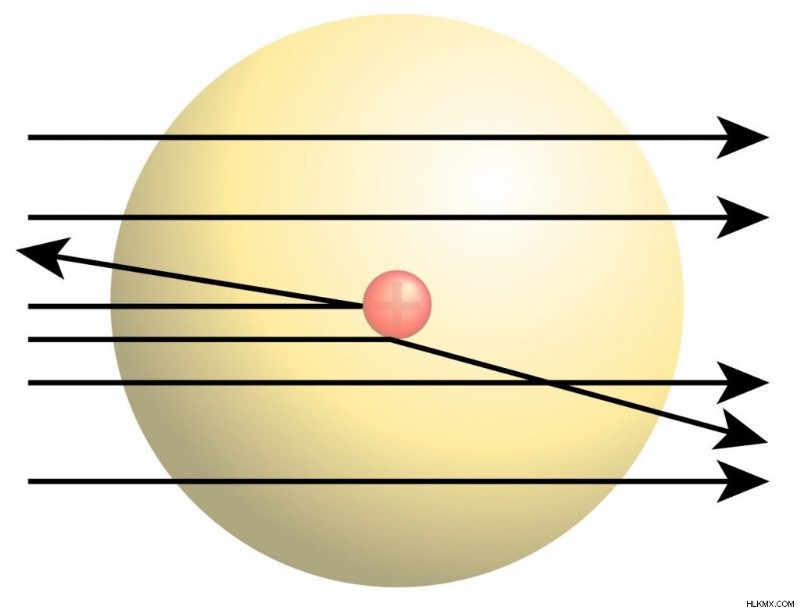
散乱実験としても知られるラザフォード金箔実験は、モデルの作成につながり、原子の部分を説明しました。 1909 年、大学院生のアーネスト マースデン (アーネスト ラザフォードの監督下) は、金箔にアルファ粒子を発射しました。粒子のほとんどはホイルを直接通過しました。つまり、各原子の空間の大部分は占有されていませんでした。ただし、いくつかの粒子はそらされ、一部は後方にさえありました。これは、フォイル内の正電荷の小さなポケットがアルファ粒子を反発することによって引き起こされたに違いありません。彼らの発見は、ラザフォードのモデルの作成につながりました。このモデルでは、高密度で正に帯電した原子核が各原子の中心の非常に小さな領域を占めています。
ラザフォード モデルの欠点
今日の一般的なモデルはラザフォード原子理論に基づいていますが、全体像を描いているわけではありません:
- モデルにはパーツがなく、電子の位置や分布が考慮されていません。
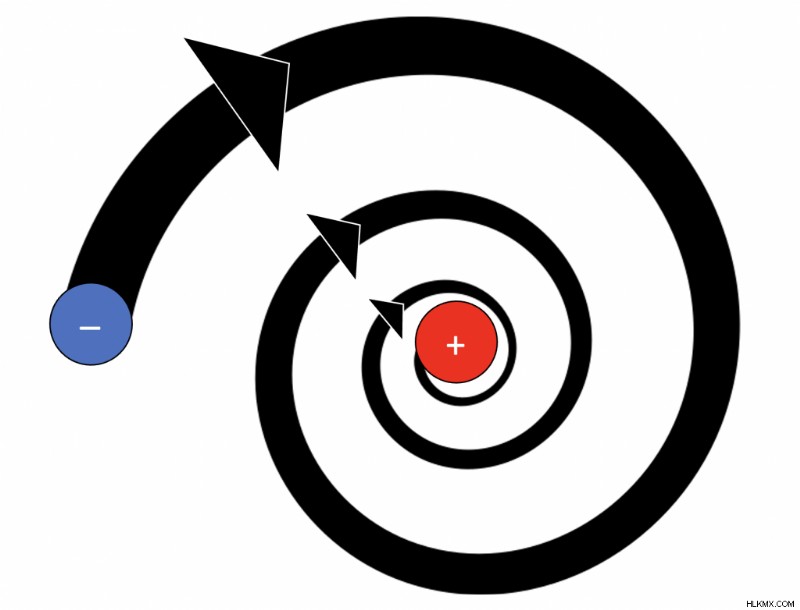
- ラザフォードは、電子が設定された経路で原子核の周りを周回することを提案しましたが、マクスウェルの理論によれば、原子は安定していないため、これは不可能です。軌道上の電子からの電磁放射により、原子は 10 秒で原子核に崩壊します。
- 電子は、加速によってエネルギー レベルがランダムに増減し、常に標準的な円軌道にあるとは限りません。それらは、周回の円運動により電磁放射を放出します。したがって、エネルギー保存の法則により、ある程度の初期エネルギーを持っている必要があります。ラザフォード原子モデルは、初期エネルギーとその後のエネルギー レベルの変化を考慮していません。
さらに読む
- ダルトンの原子論
- ボーア原子モデル
- 原子の構造