あなたが子供の頃、年長者はあなたに緑の葉野菜を食べるように圧力をかけたに違いありません.理由を聞くと、成長と健康に良いとのことでした。彼らは緑の野菜を食べることの他の多くの利点をあなたに伝えなければなりません.
しかし、それらの豊かな緑の野菜は、繊維が豊富であることに加えて、シュウ酸の優れた供給源であることを知っていますか?シュウ酸や他の多くの形態のシュウ酸塩を含む他の多くの食品を消費します.しかし問題は、シュウ酸塩とは何ですか?シュウ酸とは?
シュウ酸塩とシュウ酸について詳しく知るために、この記事に飛び込みましょう。
シュウ酸とは?
シュウ酸は無色のジアニオンです。その IUPAC 名はエタンジオエートです。一部の食品では、それらは自然に発生します。シュウ酸の共役塩基であり、シュウ酸ジアニオンとしても知られています。シュウ酸塩は、シュウ酸の塩のような誘導体に対して操作されることがよくあります。例えば、シュウ酸ジメチルまたはシュウ酸ナトリウム。 C2H2O4、つまりシュウ酸のカルボキシル基を脱プロトン化することで得られます。
通常の条件下では、シュウ酸イオンは無毒です。ただし、悪環境では有毒になる可能性があります。
シュウ酸構造
シュウ酸イオンの分子式はC₂O₄⁻²です。平面構造で存在します。シュウ酸イオンを平面にするものには 2 つの部分があります。シュウ酸塩の構造は -O₂C-CO₂-、または 2 つのカルボン酸塩が結合したものです。
カルボキシレートは、カルボニル炭素がsp²混成であるため、それ自体が平面です。酸素の 1 つと炭素の間に二重結合 (=) があります。
シュウ酸構造では、2 つのカルボキシレートがあり、それぞれが平面ですが、分子全体が平面である場合、それらの間の二面角は 0° または 180° である必要はありません。角度がおよそ 0° または 180° (つまり、フラット) になる原因は、両端の C=O 結合間の軌道相互作用が最大になるためです。
シュウ酸イオンの構造は次のとおりです。
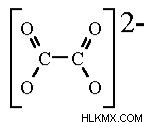
シュウ酸イオンの使用
天然のシュウ酸は人体に有害です。しかし、いくつかの人工シュウ酸は、多くの点で人類に役立ちます.これらの用途のいくつかは
- バリウムとストロンチウムのシュウ酸塩は、化学および火工品の実験室で還元剤として機能します。
- シュウ酸エスシタロプラムは、不安やうつ病の治療に役立ちます.
- カルシウムのシュウ酸塩はセラミック材料の製造に使用されます。
- シュウ酸第二鉄は、プラチナ版画やその他多くの目的で使用されます。
- シュウ酸イオンは、金属イオンの優れた配位子として機能します。
- シュウ酸水素カリウム、すなわちスイバの塩は、スイバ植物に存在するため、化学試薬として使用されます。また、インク汚れの除去や写真撮影にも利用されています。
- シュウ酸塩は、含まれる金属の供給源として使用されます。
- シュウ酸コバルトはコバルト触媒の製造に利用されています。
シュウ酸とその分子式
シュウ酸は有機酸です。ほうれん草、トマト、その他の野菜に含まれています。体内では、体内の酵素である「オキサロアセターゼ」によって分解されるオキサロ酢酸から合成されます。シュウ酸は、腫瘍の増殖を防ぐ乳酸脱水素酵素酵素を阻害します。漂白剤として使用されます。
シュウ酸は、分子式 C2H2O4 を持つ有機化合物です。これは、水中で無色の溶液を形成する無色の結晶性固体です。シュウ酸の IUPAC 名はエタン二酸です。
シュウ酸構造
シュウ酸の構造を以下に示します:
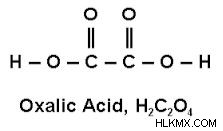
炭素原子の価数に応じて、炭素原子と酸素原子と 3𝜎結合と 1𝜋結合を形成します。 C-C結合と-C-O-H結合の間に2つの𝜎-結合が形成され、C=O原子間に二重結合が形成されます。
シュウ酸構造には、無水物と二水和物の 2 つの形態があります。無水の状態では、鎖状構造で存在し、その結果、シート状のパターンを形成します。二水和物形態では、結晶構造を形成します。
シュウ酸の調製
シュウ酸の調製にはさまざまな方法があります。これらを以下に示します:
1.硝酸 (HNO₃) による場合:
シュウ酸は、五酸化バナジウム (V₂O₅) などの触媒の存在下で、強力な酸化剤である硝酸によって特定の炭水化物 (たとえばスクロース) を酸化することによって調製されます。
C₁₂H₂₂O₁₁ + 18[O] → (COOH)₂ + H₂O
2.電極触媒による:
この方法では、シュウ酸が電極触媒作用を受けます。銅錯体の助けを借りて、二酸化炭素 (CO2) はシュウ酸に還元されます。この手順では、大量の二酸化炭素が使用されます。
3.エチレングリコールの助けを借りて:
酸化すると、酸性二クロム酸カリウムと硫酸を含むエチレングリコールがシュウ酸を生成します。化学反応は次のとおりです:
(CH₂OH)₂ + 4[O] → (COOH)₂ + 2H₂O
4.シアンによって:
濃塩酸でシアンを加水分解すると、シュウ酸が得られます。化学反応は次のとおりです:
(CN)₂ + 4H₂O + 2HCl → (COOH)₂ + 2NH4Cl
5.アルコールのカルボニル化による:
このプロセスでは、アルコールのカルボニル化によってシュウ酸ジエステルが得られます。
6.ギ酸ナトリウムから:
このプロセスでは、アルカリ触媒の存在下でギ酸ナトリウム(OHCO-Na+)からシュウ酸が調製される。この方法はさらに、シュウ酸ナトリウム (C2O4Na2) の形成をもたらし、これは後にシュウ酸に変換されます。行われる化学反応は次のとおりです:
OHCO⁻Na⁺ + 400°C 熱 → C₂O₄Na₂ + H₂
C₂O₄Na₂ + aq. Ca(OH)₂ → [C₂O₄]⁻²Ca⁺² + NaOH
[C₂O₄]⁻²Ca⁺² + H₂SO₄ → (COOH)₂ + CaSO₄↓
シュウ酸の性質
シュウ酸の物理的および化学的性質を以下に示します:
1.物理的特性:
シュウ酸のいくつかの物理的性質を以下に示します:
- 最小の二重カルボン酸です。
- シュウ酸の化学式は、C₂H₂O₄ または (COOH)₂ です。
- 無臭で白色の結晶性固体です。
- 無水物と二水和物の 2 つの形態があります。
- 無水シュウ酸のモル質量は 90.034 g/mol で、二水和物は 126.065 g/mol です。
- 無水シュウ酸の密度は 1.90 g/cm³ で、二水和物は 1.653 g/cm³ です。
- シュウ酸の融点は 189~191°C です。
- 水へのシュウ酸の溶解度は、室温で 118 g/L です。
- 通常、水和型 (COOH)₂⋅2H₂O で見られます。
- これは水溶性のカルボン酸であり、水中で H⁺ イオンを放出するため、酸性溶液を形成します。
2.化学的性質:
シュウ酸のいくつかの化学的性質を以下に示します:
- 最も単純で最強のジカルボン酸です。カルボン酸と同様に反応し、エステル誘導体と酸塩化物を形成します。
- 五塩化リン (PCl₅) と反応してオキシ塩化リンを生成します。
- 無水シュウ酸は親水性で、水を引き付けます。
- 酸性度が強く、2 つのプロトンを容易に供与できます。
- 加熱すると、シュウ酸から二酸化炭素が除去されてギ酸が生成されます。
(COOH)₂ + 熱 → HCOOH + CO₂
- H₂SO₄ の存在下でシュウ酸を加熱すると、一酸化炭素、二酸化炭素、および水が生成されます。
(COOH)₂ + 熱 (H₂SO₄ 存在下) → CO + CO₂ + H₂O
- 過マンガン酸カリウムの定量分析に使用されます。
- シュウ酸を KMnO4 または K₂Cr₂O₇ で酸化すると、二酸化炭素と水が形成されます。
(COOH)₂ + [O] → 2CO₂ + H₂O
- 多くの金属陽イオンに対する優れたキレート配位子として機能します。
シュウ酸の使用
シュウ酸のさまざまな用途を以下に示します:
- シュウ酸の約 25% は染色および印刷業界で使用されています。
- パルプ材の漂白に使用されます。
- 還元剤として機能します。
- シュウ酸洗浄または漂白の主な用途、特に配管パイプなどに見られる錆を除去するため。
- ランタニド化学では、重要な試薬の 1 つです。
- シュウ酸を使用する養蜂家もいます。
- 実験室、分析、染料中間体、およびクロマトグラフィー分析試薬として使用されます。
- シュウ酸は木材の漂白剤です。水が浸透したときに木材に結合する溶媒和鉄によって発芽した黒い斑点を取り除きます。
- アルミニウム陽極酸化プロセスで使用されることがあります.
- レアメタルの精製にも使用されます。
- 抗生物質などの医薬品の製造に使用されます。
結論
植物における炭水化物の不完全な酸化は、シュウ酸化合物の合成につながります。シュウ酸塩と反応している間、多くの金属イオンが非溶解性の沈殿物を形成します。また、配位化合物を形成することもできます。シュウ酸カルシウムはこの種の一般的な塩であり、シュウ酸はシュウ酸イオンのプロトン化によって形成される最も一般的な酸です。最も一般的なシュウ酸の主成分は、腎臓結石の形で人体に存在する可能性があります.
よくある質問
1) シュウ酸イオンによる健康被害はありますか?
A) シュウ酸塩は、尿細管を閉塞する腎臓結石の形で変化する場合があります。腎臓結石の約 80% は、シュウ酸カルシウム塩のみが原因です。
体内のシュウ酸イオンは、鉄やカルシウムなどの二原子金属陽イオンと結合し、対応するシュウ酸塩の結晶を生成します.これらの結晶は尿から排泄されます。
2) シュウ酸塩の天然源は何ですか?
A) シュウ酸は、野菜や果物、ナッツ、種子、豆類、穀物、チョコレート、お茶など、多くの食品に自然に含まれています。シュウ酸レベルが高い食品には、ビーツ、ほうれん草、ルバーブ、ピーナッツ、サツマイモ、チョコレートなどがあります。
3) 体内のシュウ酸塩が病気を引き起こす原因は?
A) シュウ酸塩はシュウ酸のイオン形態であり、さまざまな食物源から体内で形成される有毒な酸です。これらの食品は消化管で吸収されます。これらのシュウ酸結晶は、体内でのカルシウムの吸収と利用を妨げます。その結果、骨軟化症やくる病などの病気を引き起こします。これらの病気は、骨の弱体化に関連しています。







