コア コンセプト
このチュートリアルでは、タンパク質構造を構成するものと、温度や pH などの要因がタンパク質の安定性にどのように影響するかを学びます.また、タンパク質の構造と安定性がタンパク質の機能にとって重要であることも学びます。
他の記事で取り上げるトピック
- アミノ酸チャート
- 細胞シグナリングとは?
- GPCR – Gタンパク質共役受容体
- 酵素 – 機能と種類
- 解糖:分解してみましょう!
タンパク質の構造と安定性とは?
タンパク質の構造 タンパク質がとる特定の形状を説明します。タンパク質は、その構造が非常に硬い場合もあれば、非常に弛緩している場合もあれば、その中間の場合もあります。水素結合のような化学的相互作用は、これらの構造を一緒に保持する接着剤のように機能します。タンパク質の一次アミノ酸配列は、これらの化学的相互作用のどれがどこで形成されるかを決定する大きな要因です。
タンパク質は動的です。彼らは常に動いています!これは、原子が振動するような小さな動きや、タンパク質が全体的な形を変えるような大きな動きを意味する可能性があります。 タンパク質の安定性 タンパク質がどれだけうまく「静止」しているかの尺度です。言い換えれば、タンパク質がどれだけ効果的に特定の形状を維持しているかです。タンパク質は通常、いくつかの安定した形状をとることができます。生化学者は、細胞内のような生物学的条件でタンパク質がどのような形状を占めるかに引き続き関心を持っています.
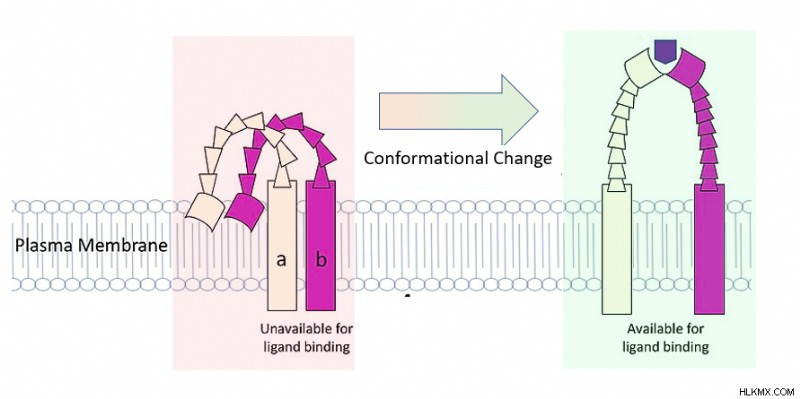
タンパク質の構造
タンパク質構造が重要な理由
人間の体には数万個のタンパク質が存在します。それらはすべて異なる役割を持っており、多くは生命に不可欠です。彼らのさまざまな役割を決定するものは何ですか? タンパク質の形状は、その動作の主要な要因です。 例えば、ヘモグロビンは体内で酸素を取り込み、運び、放出するための形状をしています。しかし、タンパク質ケラチンはヘモグロビンのようには見えず、酸素を運ぶことができません.代わりに、髪や爪を構成する強力な繊維を形成します。
タンパク質の構造を決定するものは?
タンパク質はそれ自体との相互作用を形成します。
タンパク質を構成するアミノ酸には、その形状を保持するのに役立つ化学的特性があります。たとえば、タンパク質の一次構造では、アミノ酸が共有結合を介して結合し、長くて耐久性のある鎖を形成します。さらに、これらのアミノ酸は、下の表のような他のタイプの相互作用を形成することができ、より複雑な全体的な形状を維持するのに役立ちます.
タンパク質の構造は、接着剤のように機能するいくつかの基本的な化学相互作用に基づいて構築されています。これらには、イオン結合、水素結合、ファン デ ワールス力、およびジスルフィド結合が含まれます。以下の表は、これらの力の優れた紹介です。ただし、完全なリストではありません。たとえば、アミノ酸は、パイスタッキングと呼ばれるより複雑な接触を受ける可能性があります。
| タンパク質相互作用 | 説明 |
| イオン結合 | イオン結合は、電荷に基づいて原子または分子間に形成されます。アミノ酸側鎖または R 基は、正電荷 (リジンなど)、負電荷 (アスパラギン酸など)、または中性 (グリシンなど) のいずれかです。正に荷電したアミノ酸は、負に荷電したアミノ酸を引き寄せます。より一般的には、タンパク質の正の領域が負の領域を引き付け、強いイオン結合を形成します。 |
| 水素結合 | 水素結合は、わずかに正の水素原子 (酸素、窒素、またはフッ素に結合している) と別の O、N、または F 原子との間に形成される強力な静電相互作用です。これらは、多くの生体分子にとって重要な相互作用です。|
| ファン デル ワールス | ファン デル ワールス (ロンドン分散) の力は弱く、非常に近接して発生します。ここでは最も弱い相互作用ですが、タンパク質の構造を維持する上で依然として重要な役割を果たしています。 |
| ジスルフィド結合 | ジスルフィド結合は、硫黄原子間の共有結合であり、典型的にはアミノ酸のシステイン上に見られる。ジスルフィド結合またはブリッジとも呼ばれ、タンパク質内のアミノ酸間の結合を形成するもう 1 つの方法です。
溶媒および他の分子との相互作用
タンパク質は、これらと同じタイプの相互作用を使用して、周囲のものと化学関係を形成します。たとえば、それらはさまざまな溶媒と相互作用します。また、他のタンパク質を含む、あらゆる形状とサイズの分子と相互作用します。
ラボでは、タンパク質は水やアルコールなどの溶媒にさらされます。次に、これらの溶媒の特性に応じて異なる構造をとります。アルコール中のタンパク質はしばしば変性します つまり、構造の大部分が失われますが、アミノ酸の一次配列は保持されます。水中のタンパク質は、疎水性効果と呼ばれるものを示します .
疎水性効果
タンパク質が相互作用する主な分子の 1 つは水です。タンパク質は、親水性の「水を好む」領域と、疎水性の「水を恐れる」領域を持つことができます。タンパク質が大部分が水である環境にある場合、「水を好む」領域は水に面するように配置されます.ただし、「水を恐れる」地域は水を避け、代わりに自分自身と相互作用します。これを疎水効果といいます。ほとんどのタンパク質では、これが疎水性アミノ酸がタンパク質のコアに集中し、親水性領域が外側を構成する理由です.
他のタンパク質との相互作用からもタンパク質。その一例が、逆転写酵素と呼ばれるウイルスに含まれる酵素です。これは、二量体と呼ばれる複合体の 2 つのタンパク質で構成されています (di-は「2」を意味します)。逆転写酵素の 2 つのタンパク質は、構造の安定性と機能を相互に依存しています。
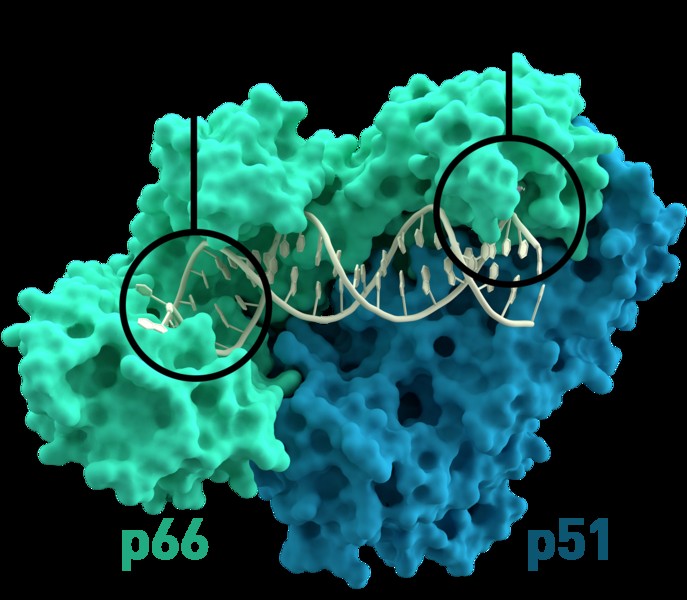
タンパク質の安定性
タンパク質の構造と安定性は密接に関係しています。水素結合など、タンパク質をその形状に保持する相互作用は、多くの要因の影響を受ける可能性があります。これらには、溶媒、pH、塩分 (存在する塩の量)、温度、および他の分子の存在が含まれます。以下の表は、これらの要因を紹介しています。
溶媒、pH、および塩分
| 係数 | 説明 |
| 溶剤 | 溶媒にはさまざまな特性が含まれている可能性があり、そのすべてがタンパク質の構造に影響を与えます。アルコール (-OH) を含む溶媒は、タンパク質構造の水素結合を形成および破壊する可能性があります。溶媒水は疎水性効果を促進します。 |
| pH | pHは、アミノ酸が酸、塩基、または中性種として作用するかどうかを決定する。これは、アミノ酸の電荷 (およびタンパク質全体の電荷) に影響を与えます。 pH の変化は、静電相互作用などの電荷に依存する接続を破壊する可能性があります。アミノ酸が酸/塩基化学を受けると、プロトンも獲得または喪失するため、pH は水素結合などの水素に依存する接続を破壊することもあります.|
| 塩分 | 塩分は、NaCl だけでなく、溶液に含まれる塩の量の尺度です。塩のイオンがアミノ酸の電荷を安定させるのに役立つため、通常、低レベルの塩はタンパク質のフォールディングに役立ちます.ただし、高レベルの塩分は、タンパク質が折りたたむために必要な相互作用を妨害する可能性があります。 |
温度とその他の分子
| 係数 | 説明 |
| 気温 | また、高温は、タンパク質構造を保持する相互作用を破壊します。タンパク質は通常、低温で安定しています。たとえば、これは極低温電子顕微鏡法 (Cryo-EM) などのタンパク質イメージング法で利用されています。 |
| 分子 | このより一般的なカテゴリには、タンパク質、小さなシグナル伝達分子、さらには塩が含まれます。タンパク質は、逆転写酵素の場合のように、その安定性を他のタンパク質に依存している場合があります。また、折り畳み、細胞輸送、シグナル伝達、およびその他の機能を他のタンパク質に依存している場合もあります。これは、タンパク質の形状の変化を伴うことがよくあります。小さなシグナル伝達分子は、タンパク質の小さな領域の化学に影響を与える可能性があり、その結果、さまざまな影響のタンパク質構造変化が生じる可能性があります. |
さらに読む
- リボ核酸 (RNA)
- 脂質 – 構造、機能、および例
- デオキシリボ核酸 (DNA)
- DNA転写の説明
- 生物学における DNA 複製