ハイブリダイゼーションは、分子内の結合が同等であることを説明するためにポーリングによって最初に導入されました。それはまた、異なる形状とほぼ等しいエネルギーを持つ原子軌道の組み合わせと、同じ形状とエネルギーを持つ新しい軌道を確立するためのエネルギーの再分配として説明することもできます。これらの新しい軌道はハイブリッド軌道と呼ばれ、この現象はハイブリダイゼーションと呼ばれます。この記事では、三フッ化臭素のハイブリダイゼーションを通じて、三フッ化臭素のハイブリダイゼーションについて学びます。
BrF3
三フッ化臭素または BrF3 はハロゲン間化合物です。この分子には、1 つの臭素原子と 3 つのフッ素原子が含まれています。分子内のこれらの原子はすべて、高い電気陰性度の値を持っています。
BrF3 は強い臭気があり、麦わら色の液体のように見えます。自然界では、BrF3 (三フッ化臭素) は極性分子です。これは、臭素原子に 2 つの非共有電子対が存在することで、分子の形が変形したり曲がったりするためです。 BrF3 分子は、臭素と 3 つのフッ素原子の間の電荷分布が均一ではないため、極性があります。
Paul Lebeau は、20°C で臭素をフッ素と反応させることにより、1906 年に初めてこの化合物を合成しました。次の方程式は反応を表します:
Br2 + 3F2 → 2BrF3
三フッ化臭素は、一フッ化臭素を同時に還元および酸化することによって生成することもできます。この反応の結果、三フッ化臭素と臭素が形成されます。
3BrF→ BrF3 + Br2
BrF3 の性質
この物質のモノアイソトピック質量は 135.913547 u です。 (統一原子質量単位).
三フッ化臭素のモル質量は 136.90 g/mol です。
吸湿性の高い液体です。
三フッ化臭素のモル質量は 136.90 g/mol です。
この物質の分子双極子モーメントは 1.19 デバイです。
物質の密度は 2.803 g/cm3 です。
この物質の沸点は 125.72°C です。
自己イオン化により、液体は電気の良導体です。
非常に腐食性の液体です。
温度が 68.0°F の場合、三フッ化臭素の比重は 2.81 です。
この物質の分子双極子モーメントは 1.19 デバイです。
三フッ化臭素のハイブリダイゼーション
三フッ化臭素の混成を評価するために、まず中心原子である臭素の電子配置を調べます。次のように書かれています:
1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁵
しかし、臭素の一部の電子は 4d 軌道に移動して、フッ素原子との結合を形成します。さらに、フッ素はより高い酸化能力を持っているため、臭素を強制的に電子を上記のレベルまで促進させます。臭素は、d 軌道を使用してハイブリダイズできるようになりました。
最も外側の殻に、BrF3 は 7 つの電子を持っています。また、結合が形成された後、2 つの非共有電子対と 3 つの Br-F 共有結合も持つことになります。電子対の混成値は 5 に等しいため、sp3d 混成軌道が形成されます。
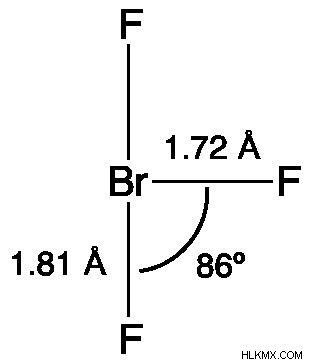
BrF3 の構造
三フッ化臭素のルイス構造は、T字型の分子構造を持っていることを示しています。分子形成の VSEPR 理論によると、中央の臭素は 2 つの電子対に関連付けられています。臭素中心と赤道フッ素の間の距離は 1.72 Å であり、臭素中心と各軸方向フッ素の間の距離は 1.81 Å です。 86.2° は、赤道フッ素と軸方向フッ素によって形成される角度です。 Br-F 結合からの反発圧力は電子対の力よりも小さいため、角度は 90° よりわずかに小さく保たれます。
BrF3 の極性
BrF3 分子は非極性に分類されます。
Br 原子と F 原子の電気陰性度が大きく異なるためです。電荷は分子全体に均一に分布していません.
臭素原子の孤立電子対のため、BrF3 の形状は非対称であり、これも不均一な電荷分布の一因となっています。
このような非極性分子は正味の双極子モーメントがゼロではありません。
BrF3のMOD
分子軌道図を使用して、分子内の電子の位置と挙動を説明できます。価電子対との孤立電子対結合の形成は、分子の物理的特性に影響を与えます。この機能は、これらが結合を形成するときに特定の領域で電子を見つけることによって、ハイブリダイゼーションの形状を識別します。
MO 理論は、電子対のエネルギー的および空間的特性に関係しています。また、原子軌道が線形結合して分子軌道を形成する方法についても説明します。
BrF3 の式の書き方
BrF3 分子にはいくつの価電子がありますか? Br と F はどちらも周期表のグループ 7 のハロゲンです。
結果として、これらの元素は両方とも 7 価になります。BrF3 の価電子の総数
=7 + 7*3
=7 + 21
=28.
どの原子が中心原子として機能しますか?
原則として、電気陰性度が最も低い元素を中心に置きます。電気陰性度チャートによると、臭素の電気陰性度は 2.96 で、F の電気陰性度は 3.98 です。次に、原子の周りに 28 個の価電子をラップしてオクテットを完成させます。このシステムのすべてのアトムは、オクテット構成になりました。 3 つの F 原子と Br 原子のそれぞれ。
これが BrF3 の最良のルイス構造形成であるかどうかを判断するには、まず別の概念を理解する必要があります:形式電荷.存在するすべての原子間で結合が均等に共有されている場合に、化学分子内の構成原子に割り当てられる電荷は、形式電荷として知られています。
ルイス構造を形成するには、まずすべての原子の形式電荷値が可能な限り低いかどうかを判断する必要があります。
BrF3 の計算をしましょう:
正式料金 =7- 0.5* 2 -6 =0
Br:フォーマルチャージ =7-0.5*6-4 =0
3 つの F 原子と 1 つの Br 原子の形式電荷値はすべてゼロであることがわかります。その結果、最も適切な LS ダイアグラムを既に取得していると結論付けることができます。
結論
この記事では、三フッ化臭素ノートのハイブリダイゼーションによる三フッ化臭素のハイブリダイゼーションについて説明します。 BrF3 のハイブリダイゼーションは sp³d であり、その構造は T 字型または三角両錐体型です。三フッ化臭素は非極性分子です。上記の手順で BrF3 の式を書くことができます。