不完全な d 軌道により、遷移金属の色が変化します。光の吸収が起こると、遷移金属の着色された性質が正に帯電したイオンを引き付けます。化学における化学物質の色の違いは、化学物質の物理的性質を教えてくれます。
ほとんどの場合、これらの特性は、さまざまな化学物質とそれらの反応によって完了するエネルギーの吸収による電子の励起に由来します。しかし、科学では、波長によって得られる補色にもかかわらず、私たちが見る色は吸収されません。
これは、原子分光法によって最初に観測されたスペクトル型の遠近法です。エネルギーの放出と吸収によるあらゆる構造の研究は、分光法として知られています。
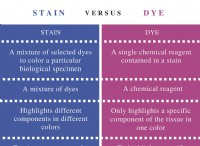
カラー コンパウンド
d ブロックである遷移金属に存在する色は、d – シェル軌道が異なるタイプのエネルギー準位に分裂するために発生します。その結果、d ブロック要素によって特定のエネルギーが吸収されます。
これは、電子が異なるエネルギー レベル間をジャンプするように発生し、その結果、補色の存在が見えるようになります。これが、色の化合物が形成される方法です。
理論は、結晶場理論として知られる色の生成を示しています。
有色イオンの形成
5 つの d 軌道すべてである遷移元素のイオンと孤立した原子は、同様のエネルギーを持ち、縮退として知られています。これは、サンプルに可視光を当てたときに発生します。電子は、吸収のために低エネルギーから高エネルギーへと促進されます。
波長または色の光の吸収があります。太陽光の残留物が透過しやすい。透過光が吸収される補色があります。これが有色イオンの形成方法です。したがって、生成された溶液または化合物は補色であると言われます。
次のような有色イオンの形成:
- d 軌道の低エネルギーからの電子は、d 軌道の高エネルギーに転送されます。吸収される光量の周波数は、励起のエネルギーに対応します。
- d 軌道が不完全または不対であるため、金属イオンの遷移の色が変化します。
- 目に見える光の吸収があります。したがって、遷移金属の着色された性質は、同様のサブシェル内で低エネルギーから高エネルギーへの 1 つまたは複数の不対 d 電子のアップグレードによるものです。アップグレードには、可視光で利用可能な少量のエネルギーが必要です。
- Sc3+、Ti4+、Cu+、および Zn2+ は、3d 軌道が空または充填されています。これは、不対 d 電子が存在しないことを意味します。したがって、それらは無色でした。
d ブロック要素の意味
現代の化学の周期表には、さまざまな元素があります。現代の周期表の第 3 族と第 12 族の元素は、d ブロック元素として知られるようになりました。元素は通常、d-軌道の電子の原子価に分類されます。
これらの要素は、要素の s ブロック要素と p ブロック要素の間の遷移タイプの動作を示し、p ブロック要素および遷移要素としても知られています。 d ブロックでは、原子価シェルに定数 no があります。電子の。ただし、最後から 2 番目の殻にある電子は上昇し続けます。これは、d ブロック要素のさまざまな種類のシェルの違いです。
酸化状態または原子の d 軌道殻に不対電子が 1 つしかない元素は、遷移元素として知られています。すべての移行要素は d ブロック要素と見なされますが、すべての d-block 要素が移行要素と見なされるわけではありません。
結論
最後に、サンプルに可視光を当てると、有色イオンの形成が起こると結論付けることができます。まず、電子は吸収のために低エネルギーから高エネルギーに昇格します。波長または色の光の吸収があります。すると、光の残りが伝わりやすくなります。最後に、透過光の補色が吸収されます。これは、有色イオンの形成の全プロセスです。 d ブロック要素についても例を挙げて説明します。