生細胞の生化学反応は、酵素によって触媒されます。酵素は不活性型で合成され、その後活性型に変換されます。酵素の活性は、一次構造のアミノ酸配列によって決まります。基質は、特定の化学反応を特異的に促進するために、酵素の活性部位に結合します。酵素の活性部位は、基質結合部位および触媒部位を含む。活性部位のアミノ酸残基によって生成される特定の化学環境によって、どの基質が酵素に結合できるかが決まります。
この記事では、
1.酵素とは何か、どのように働くのか
2.酵素の活性部位とは
3.酵素と基質はどのように結合するのか
酵素とは何か、どのように機能するのか
酵素は、生物学的触媒として機能するタンパク質分子です。酵素が作用する分子は基質と呼ばれます。特定の基質に対する酵素の作用によって生成されるさまざまな分子は、生成物と呼ばれます。酵素は、その活性化エネルギーを下げることによって生化学反応を触媒します。酵素による反応の触媒作用は、細胞内のその特定の反応の速度を増加させます。一部の酵素は、同じ反応を触媒することができます。それらはアイソザイムと呼ばれます。約 3,000 種類の酵素のユニークなセットは、合成されるように遺伝子的にプログラムされており、細胞に個性を与えています。タンパク質以外に、リボザイムなどの RNA 分子も酵素として機能します。 1 つの酵素に欠陥があると、その影響は悲惨なものになります。
酵素には 3 つの特徴があります。酵素の主な機能は、反応速度を高めることです。第二に、1 つの特定の酵素が 1 つの特定の基質に特異的に作用し、生成物を生成します。第三に、酵素は低活性から高活性に、またその逆に調節できます。酵素への基質の結合、反応速度の増加による生成物の生成、および生成物の放出を 図 1 に示します。 .
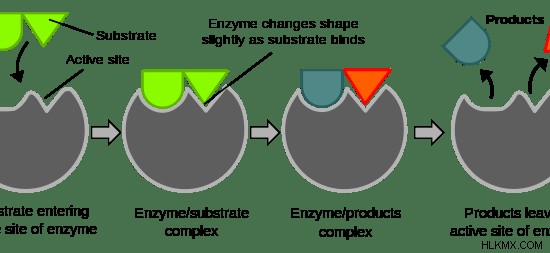
図 1:酵素の働き
酵素の活性は、主にタンパク質鎖のアミノ酸配列に依存します。酵素は、その一次構造と呼ばれるアミノ酸の直線配列として合成されます。一次構造は、二次構造と呼ばれるアルファ ヘリックスおよび/またはベータ シートで構成される 3D 構造に自発的に折り畳まれます。酵素の二次構造は、三次構造と呼ばれるコンパクトな 3D 構造に再び折り畳まれます。酵素の三次構造は、不活性な形で存在します。
酵素複合体のポリペプチドまたはタンパク質部分は、アポ酵素と呼ばれます。最初に合成された構造におけるアポ酵素の不活性型は、プロ酵素またはチモーゲンとして知られています。ポリペプチド部分をアポ酵素に変換するために、チモーゲンからいくつかのアミノ酸が除去される。ほとんどの場合、アポ酵素は補因子と呼ばれる他の化合物と結合して、反応を触媒します。アポ酵素と補因子の組み合わせは、ホロ酵素と呼ばれます。 図 2 に、アポ酵素、補因子、およびホロ酵素の関係を示します。 .
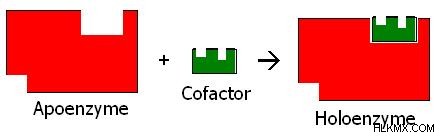
図 2:アポ酵素、補因子、およびホロ酵素
酵素の活性部位とは
酵素の活性部位は、特定の基質が酵素に結合し、化学反応を触媒する領域です。基質結合部位は、触媒部位とともに酵素の活性部位を形成します。酵素は、何らかの方法で基質を変化させる化学反応を触媒するために、特定の基質と結合します。基質はその酵素より小さいサイズです。基質は、活性部位によって酵素内で完全に配向されています。酵素には、1つまたは複数の基質結合部位が見られます。触媒部位は結合部位の隣にあり、触媒作用を実行します。これは、触媒作用に関与する約 2 ~ 4 個のアミノ酸で構成されています。活性部位を形成するアミノ酸は、酵素のアミノ酸配列の異なる部分に位置しています。したがって、酵素の一次構造は 3D 構造に折り畳まれ、活性部位が結合できるようになります。酵素の活性部位であるリゾチームは、図 3 に示されています。 .基質であるペプチドグリカンは黒色で示されています。
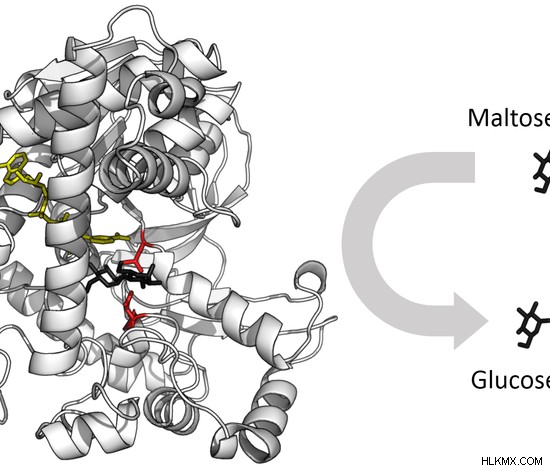
図 3:酵素の活性部位
活性部位とは異なり、酵素にはエフェクター分子に結合するポケットが含まれており、酵素のコンフォメーションやダイナミクスを変化させます。これらのポケットは、酵素の反応速度のアロステリック調節に関与するアロステリック サイトとして知られています。
酵素と基質はどのように結合するのか
酵素の結合部位は、基質特異的に基質と結合します。この結合は、触媒作用のために基質を配向します。酵素の結合部位にあるアミノ酸残基は弱酸性または弱塩基性です。親水性または疎水性;正電荷、負電荷、または中性。結合部位内に作られる非常に特異的な化学環境が、酵素の特異性を決定します。ファン デル ワールス力、親水性/疎水性相互作用、水素結合などの一時的な共有相互作用が、基板との活性部位によって形成されます。酵素は基質とともに酵素-基質複合体を形成します。
酵素への基質の結合は、ロック アンド キー モデルと誘導適合モデルの 2 つのメカニズムで発生します。 ロック アンド キー モデル は、基質が 1 つの瞬間的なステップで酵素と正確に適合することを主張します。この結合により、酵素の構造がわずかに変化します。ロック アンド キー モデルでは、適切なサイズと形状の基質のみが酵素と結合できます。 誘導適合モデル中 、酵素の活性部位の形状は、基質結合に応答して連続的に変化します。これは、他の分子が酵素の活性部位に結合する理由を説明しています。しかしながら、この基質の酵素への動的結合は、基質を安定化し、生化学反応の速度を増加させる。ヘキソキナーゼは、その基質、アデニン三リン酸、およびキシロースの形状に適合して、その形状を変化させる酵素です。ヘキソキナーゼの誘導適合モデルを 図 4 に示します .結合部位と基質は青と黒で示されています。
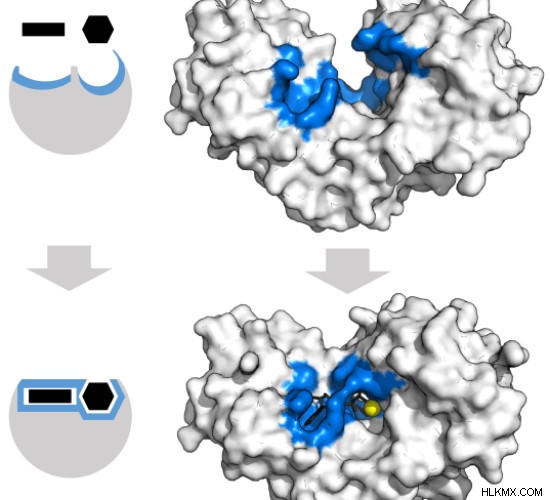
図 4:ヘキソキナーゼの誘導適合モデル
酵素による化学反応の触媒作用は、化学反応の活性化エネルギーを低下させるいくつかの方法で発生する可能性があります。まず、酵素は遷移状態の電荷分布に相補的な電荷分布を作り、そのエネルギーを下げることで遷移状態を安定化します。第二に、酵素は、元の遷移状態のエネルギーよりも低いエネルギーを持つ 2 番目の遷移状態を含む別の反応経路を促進します。第三に、酵素は基質の基底状態を不安定にします。
結論
酵素は、生細胞の生化学反応の速度を高める化学反応です。ほとんどの酵素は、一次構造で合成されるタンパク質です。これらのアミノ酸鎖は 3D 構造に折り畳まれ、活性型の酵素を生成します。この折りたたみにより、活性部位と呼ばれる酵素内にポケットが作成されます。基質は酵素の活性部位に特異的に結合し、体内で発生する生化学反応の速度を高めます。
参照: 画像提供:
1.「生化学反応における酵素の役割」。酵素。 N.p.、n.d.ウェブ。 2017 年 5 月 21 日
2.「酵素と活性部位」カーンアカデミー。 N.p.、n.d.ウェブ。 2017 年 5 月 21 日。
3.「酵素活性部位と基質特異性」。無限。 2016 年 11 月 17 日。ウェブ。 2017 年 5 月 21 日。
1. 「誘導適合図」TimVickers によって作成され、Fvasconcellos によってベクトル化された – TimVickers (パブリック ドメイン) によって Commons Wikimedia 経由で提供
2. 「酵素」Thomas Shafee 著 – 自身の作品 (CC BY 4.0) Commons Wikimedia 経由
3. 「酵素構造」Thomas Shafee 著 – Commons Wikimedia による自作 (CC BY 4.0)
4. 「ヘキソキナーゼ誘発性適合」Thomas Shafee著– Commons Wikimedia経由の自作(CC BY 4.0)







