コア コンセプト
この記事では、求電子芳香族置換の基礎、重要なメカニズム、および位置選択性について学びます。
求電子芳香族置換とは?
ベンゼンのような芳香族化合物の驚くべき安定性にもかかわらず、有機化学者はそれらの構造を化学的に変える方法を発見しました。合成では、これらの変化は通常、芳香環の水素が新しい化学基に置き換わる置換反応によって起こります。重要なことに、これらの反応は芳香族化合物の電子の循環運動を維持し、化学的安定性を維持します。
求電子芳香族置換 (EAS) では、炭化水素、硝酸塩、または硫酸塩などの求電子基が芳香環に付加されます。 EAS には、適切に求核芳香族置換 (NAS) と呼ばれる、求核剤を含む対応物があります。 EAS と NAS は同様のメカニズムに従いますが、EAS の反応には NAS で共有されていない独特の癖があります。
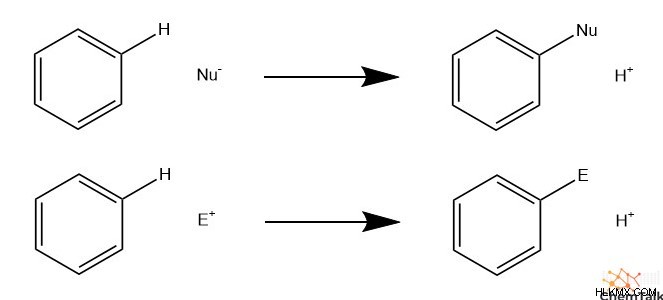
求電子芳香族置換メカニズム
求電子置換反応の最初のステップでは、求電子試薬を攻撃する芳香環からの 1 対のパイ電子が関与します。これにより、環の芳香族性が一時的に破壊され、求電子剤に結合した炭素に正電荷が置かれます。次に、一般的な塩基が正の炭素を脱プロトン化し、電子対を解放します。最後に、この電子対は炭素環構造内でパイ結合を形成し、再び芳香族になります。
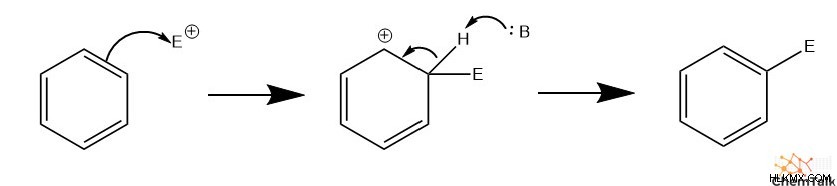
重要なことは、化合物の芳香族性は EAS 中に一時的に停止する必要がありますが、最終生成物を形成するために戻ります。芳香族構造への化学的変化は、多くの場合、反応が完了すると芳香族性が戻る必要があります。これは、芳香族化合物の顕著な安定性によるものです。芳香族構造を非芳香族構造に完全に変換する反応の場合、そのような反応は、劇的な環境条件や非常に効果的な触媒がなければ、熱力学的に好ましくない可能性があります。
求電子芳香族置換の例
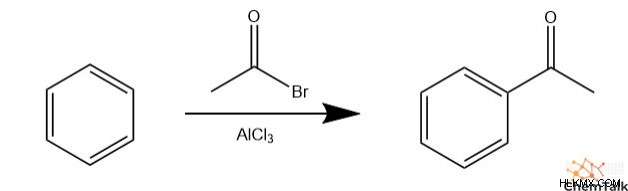
Friedel-Crafts アルキル化
炭化水素を芳香環に配置するには、フリーデル クラフツ アルキル化と呼ばれる特定の EAS 反応が発生する必要があります。この反応には、2 つの重要な反応物、ハロゲン化アルキルとルイス酸 (通常は AlCl
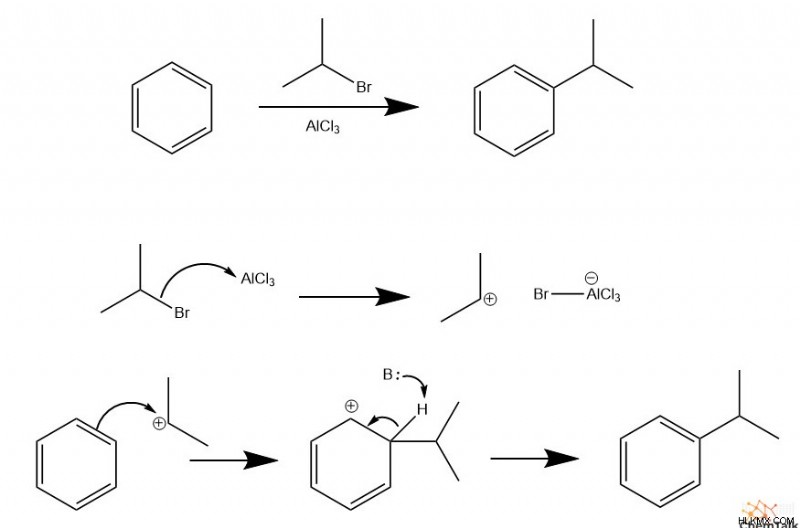
化学者は、「フリーデル-クラフツ アシル化」という用語を使用して、ハロゲン化アルキルの代わりに酸ハロゲン化物が関与する同様の反応を説明しています。
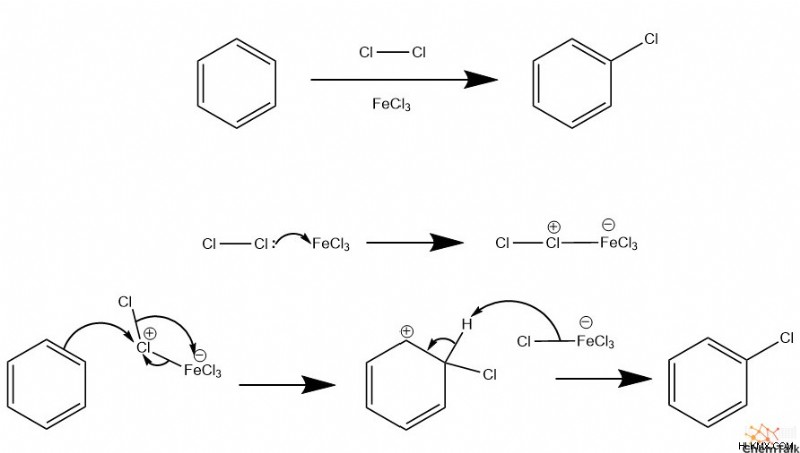
ハロゲン化
芳香環をハロゲン化するには、ルイス酸、通常は FeCl3 も必要です または FeBr3 、および二原子ハロゲン。ルイス酸はハロゲンに結合するため、求電子性が高くなります。次に、求電子性ハロゲンは、芳香族物質とのEASを実行することができます。ハロゲン-ルイス酸中間体の複雑さのため、複雑な一連の転位が EAS 中に発生する必要があります。
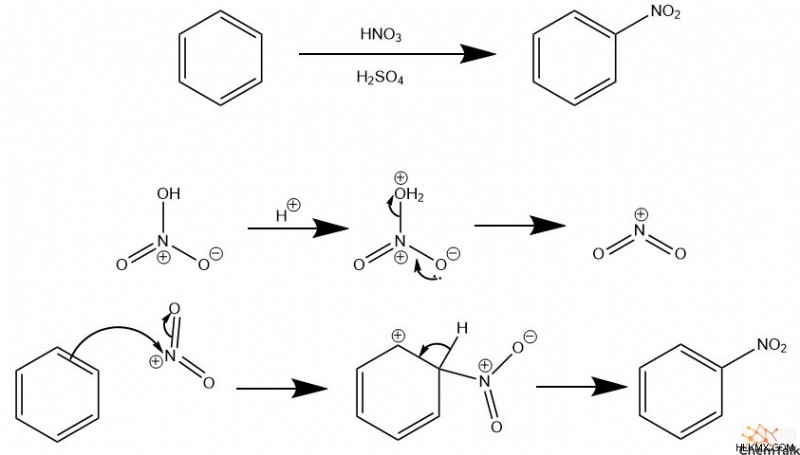
ニトロ化
ニトロ基を芳香環に配置するには、求電子芳香族置換で求電子試薬として機能するニトロニウム イオンと呼ばれる特殊な化合物を使用します。ニトロニウム イオンを生成するには、硝酸を他の酸でプロトン化する必要があります。これにより、硝酸の構造が不安定になり、ヒドロキシ基が放出されます。通常、硫酸は二次酸として機能します。その共役塩基である硫酸二水素塩は求核性が高くなく、ニトロニウムと競合して芳香環と反応しないからです。
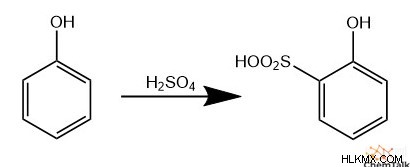
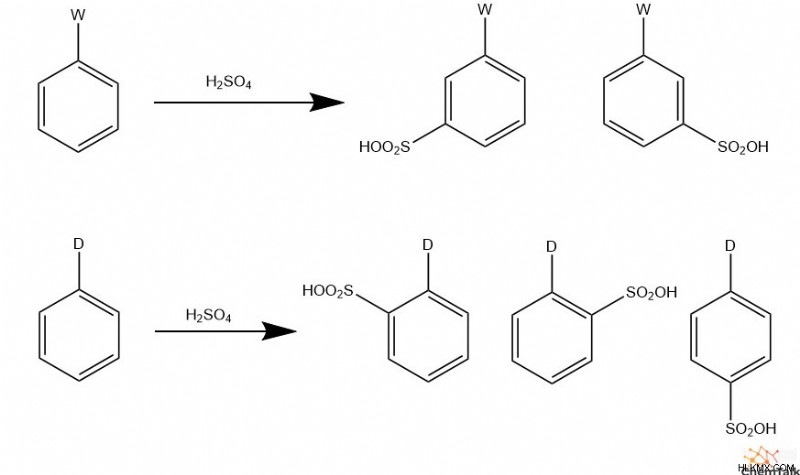
スルホン化
同様の反応に続いて、スルホン化は硫酸をそれ自体と反応させて求電子性三酸化水素硫黄を生成することを含みます。この求電子種は、芳香環を脱プロトン化した後、負に帯電した酸素をもたらすEASを実行できます。反応混合物には未反応の硫酸が存在するため、この酸素はプロトン化されます。
イプソ 代替
場合によっては、芳香環の水素を置換するのではなく、攻撃的な求電子剤が代わりに別の置換基を置換します。化学者はこれを「ipso-」と呼んでいます 置換」または「ipso -攻撃"。たとえば、サリチル酸のニトロ化を行う場合、入ってくるニトロニウム イオンは、カルボン酸を持つ炭素と反応します。これにより、カルボキシル基が二酸化炭素として環から放出されます。
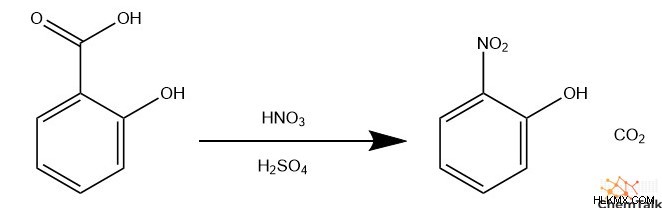
求電子芳香族置換の位置選択性
興味深いことに、芳香族化合物がすでに置換基を持っていて、EAS を実行した場合、求電子剤は他の部位よりも環上の特定の部位と反応する可能性が高くなります。分子の特定の領域が他の領域よりも反応しやすいこの傾向は、位置選択性と呼ばれます。
置換基の電子親和力は、芳香族求電子置換における位置選択性に最も影響を与えます。具体的には、一置換ベンゼンでは、電子求引基は メタ と呼ばれます 取締役。これは、求電子試薬が、置換基から 2 箇所離れた炭素との反応性が高いことを意味します。逆に、電子供与基は para/ortho と呼ばれます 取締役。これは、求電子剤が隣接する炭素との反応性が高いことを意味します (ortho ) または反対 (para ) 置換基。置換基と位置選択性との間のこれらの関係は、芳香族物質が関与する合成反応経路を知らせます。

特定の基が特定の炭素を求電子試薬に対してより反応性にする理由は、共鳴に由来します。詳しく見てみましょう。
メタ 取締役
前述のように、カルボニル、ハロゲン化物、ニトロ基などの電子求引基は、求電子試薬を メタ と結合させます。 炭素。これは、炭素 ortho に置かれた部分的な正電荷に由来します。 および para 分子の共鳴形態に由来する撤退グループに。その結果、非 メタ 炭素は静電的に求電子剤を反発させ、 メタ を作ります 炭素はEASで比較的反応性が高い.ただし、化学者はこれらの メタ を説明するために「不活化基」という用語を使用します。 電子求引基を持つベンゼンは、環構造の電子密度が減少するため、置換されていないベンゼンよりも全体的な反応性が大幅に低下するためです。
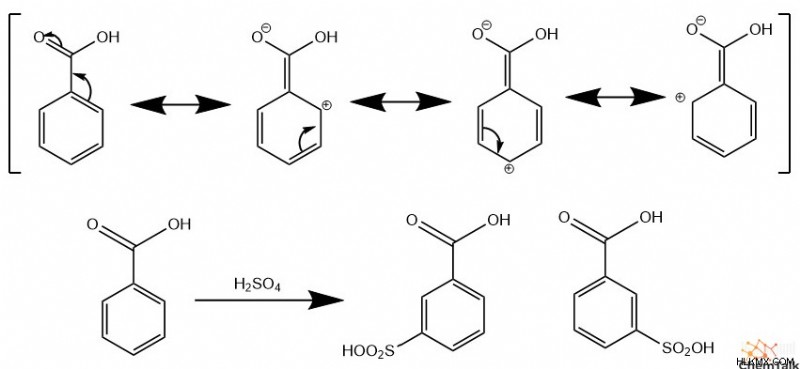
パラ/オルソ 取締役
炭化水素、アルコール、アセテート、アミノなどの電子供与基は、求電子試薬をオルトに結合させます。 および para 炭素。これは、炭素 ortho に配置された部分的な負電荷に由来します。 および para 分子の共鳴形態に由来する寄付グループに。その結果、直交 および para グループは静電的に求電子剤を引き付けます。さらに、化学者は供与基を「活性化基」と呼んでいます。これは、芳香環に電子密度を追加し、置換されていないベンゼンよりも求電子試薬に対して反応性を高めるためです。

電子供与基が与えられると、求電子剤は para と優先的に反応する可能性があります。 オルソ上の炭素 炭素またはその逆。この位置選択性のレベルは、寄付グループの立体構造に依存します。グループが大きくかさばる場合、求電子剤は para と優先的に反応します 炭素供与基の大部分が、入ってくる分子が隣接する ortho と相互作用するのを立体的に妨げているためです。 炭素。
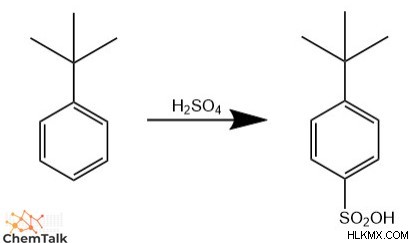
逆に、グループが小さく、立体効果がほとんどない場合、求電子剤はオルソで置換を実行する可能性が高くなります。 ベンゼンには 2 つの オルト があるため、炭素 炭素と 1 つの para のみ 炭素。具体的には、求電子剤は 2 つの ortho と反応する可能性が等しくなります。 炭素と 1 つの para 炭素なので、製品ミックスには 67% の ortho が含まれます。 製品と 33% para